a) A = \(58,67,76\%+60.26,16\%+61.2,42\%+62.3,66\%=58,7422\)
b) B = \(16.99,757\%+17.0,039\%+18.0,204\%=16,00447\)
c) C = \(55.5,84\%+56.91,68\%+57.2,17\%+58.0,31\%=55,9695\)
d) D = \(204.2,5\%+206.23,7\%+207.22,4\%+208.51,4\%=207,202\)
a) A = \(58,67,76\%+60.26,16\%+61.2,42\%+62.3,66\%=58,7422\)
b) B = \(16.99,757\%+17.0,039\%+18.0,204\%=16,00447\)
c) C = \(55.5,84\%+56.91,68\%+57.2,17\%+58.0,31\%=55,9695\)
d) D = \(204.2,5\%+206.23,7\%+207.22,4\%+208.51,4\%=207,202\)
Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau :
Đồng vị 24Mg 25Mg 26Mg
% 78,6 10,1 11,3
a. Tính nguyên tử khối trung bình của Mg.
b. Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg , thì số nguyên tử tương ứng của hai đồng vị còn lại là bao nhiêu ?
Tính khối lượng nguyên tử trung bình của các nguyên tố coban va niken. Biết rằng trong tự nhiên, đồng vị của các nguyên tố có tồn tại theo tỉ lệ sau:
59Co 58Ni 60Ni 61Ni 62Ni
(100%) (67,76%) (26,15%) (2,42%) (3,66%)
Trong tự nhiên clo có 2 đồng vị bền 35 17Cl và 37 17Cl . Nguyên tử khối trung bình của nguyên tố clo là 35,485. Tính thành phần phần trăm khối lượng của 37 17Cl có trong hợp chất HClO2
Tính nguyên tử khối trung bình của Ni theo số khối của các đồng vị trong tự nhiên của Ni theo số liệu sau: 58Ni chiếm 68,27% ; 60Ni chiếm 26,10% ; 61Ni chiếm 1,13% ; 62Ni chiếm 3,59% ; 64Ni chiếm 0,91%.
A. 58,75
B. 58,17
C. 58,06
D. 56,53
Tính nguyên tử khối trung bình của kali biết rằng trong tự nhiên thành phần % các đồng vị của kali là:
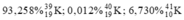
Clo tự nhiên là hỗn hợp của hai đồng vị :
Cl 35 có nguyên tử khối là 34,97.
Cl 37 có nguyên tử khối ià 36,97.
Biết rằng đồng vị Cl 35 hiếm 75,77% ; hãy tính nguyên tử khối trung bình của clo tự nhiên.
Brom có 2 đồng vị là 79br và71br Nguyên tử khối trung bình của Brom là 79,91. a) Tính % số nguyên tử mỗi đồng vị của Brom? b) Tính % khối lượng của79Br trong hợp chất CaBr2 (cho Ca = 40) ? c) Biết đồng vị 79Br có số hạt mang điện nhiều hơn số hạt không mang điện là 26 hạt. Xác định số hiệu nguyên tử của Brom ?
mng giup' em voi a.
Phát biểu nào dưới đây không đúng?
A. Nguyên tử khối là khối lượng tương đối của nguyên tử.
B. Đối với các nguyên tố có nhiều đồng vị, nguyên tử khối được tính là giá trị trung bình của nguyên tử khối các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử mỗi đồng vị.
C. Khối lượng của nguyên tử bằng tổng khối lượng của proton và electron.
D. Trong một số trường hợp, có thể coi nguyên tử khối bằng số khối.
Bài 1. Tính thành phần phần % các đồng vị của cacbon. Biết cacbon trong tự nhiên tồn tại hai đồng vị bền là 12C và 13C và có nguyên tử trung bình là 12,011.
Bài 2. Nguyên tử khối trung bình của Ag là 107,87, trong tự nhiên bạc có hai đồng vị là 107Ag và 109Ag. Xác định % số nguyên tử của mỗi đồng vị.
Tính % theo khối lượng của đồng vị 109Ag trong AgNO3 (lấy nguyê tử khối tb N = 14; O = 16)
Trong tự nhiên, nguyên tố bo có 2 đồng vị: B 11 , nguyên tử khối coi là bằng 11, thành phần 80,1% ; B 10 nguyên tử khối coi là bằng 10, thành phần 19,9%. Hãy tính nguyên tử khối trung bình của nguyên tố bo trong tự nhiên.