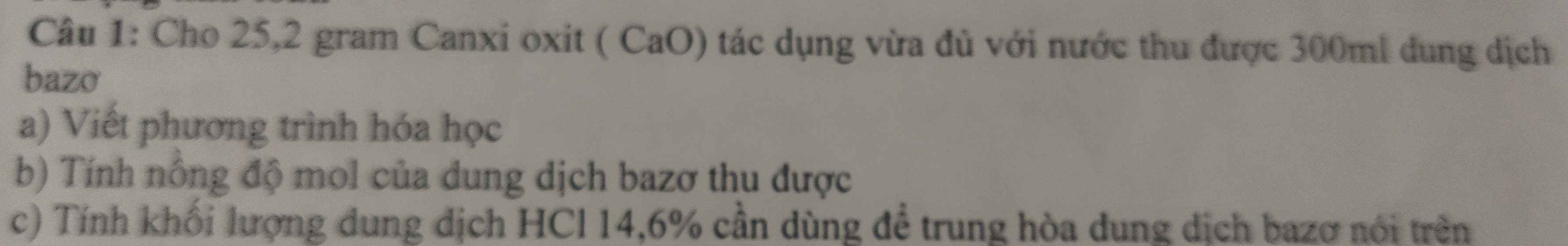Phần 1 :
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$n_{Al} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
Gọi $n_{Cu} = a(mol)$
Phần 2 :
Gọi $n_{Al} = 0,2x(mol) ; n_{Cu} = ax(mol)$
$\Rightarrow 0,2x.27 + ax.64 - 0,2.27 - 64a = 23,6(1)$
$2Al + 6H_2SO_4 \to Al_2(SO_4)_3 + 3SO_2 + 6H_2O$
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + 2H_2O$
$n_{SO_2} = \dfrac{3}{2}n_{Al} + n_{Cu} = 0,3x + ax = 1,2$
$\Rightarrow x = \dfrac{1,2}{0,3 + a}(2)$
Thay (2) vào (1) suy ra : a = 0,1 hoặc a = 0,346875
Suy ra : x = 3 hoặc x = \(\dfrac{128}{69}\)
- Với x = 3
Hỗn hợp ban đầu có : $n_{Al} = 0,2 + 0,2.3 = 0,8(mol) ; n_{Cu} = 0,1 + 0,1.3 = 0,4(mol)$
$\Rightarrow m = 0,8.27 +0,4.64 = 47,2(gam)$
- Với \(x=\dfrac{128}{69}\)
Hỗn hợp ban đầu có : $n_{Al} = 0,2 + 0,2.\dfrac{128}{69} = \dfrac{197}{345}(mol) ; n_{Cu} = 0,346875 + 0,346875.\dfrac{128}{69}=0,99(mol)$
$\Rightarrow m = \dfrac{197}{345}.27 + 0,99.64 = 78,77(gam)$