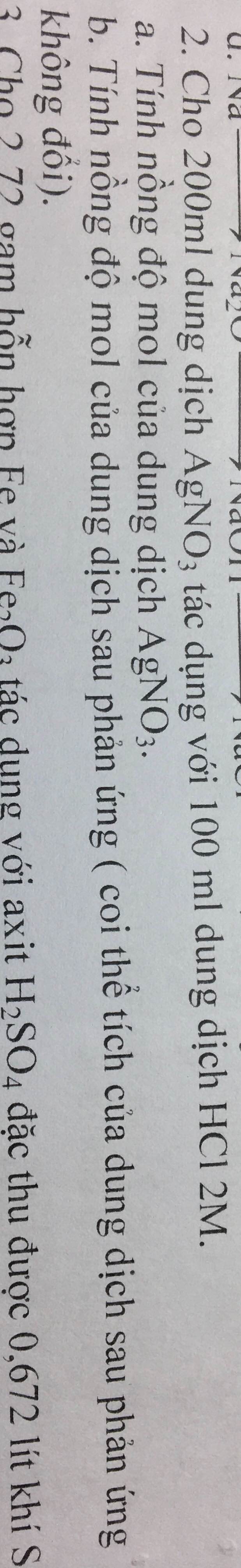$n_{NO} = \dfrac{1,344}{22,4} = 0,06(mol)$
Coi hỗn hợp X là kim loại R có hoá trị n
$3R + 4nHNO_3 \to 3R(NO_3)_n + nNO + 2nH_2O$
Theo PTHH :
$n_R = n_{R(NO_3)_n} = \dfrac{3}{n}.n_{NO} = \dfrac{0,18}{n}(mol)$
Suy ra: $\dfrac{0,18}{n}.R = 3,76(1)$
$R(NO_3)_n + nNaOH \to R(OH)_n + nNaNO_3$
$n_{R(OH)_n} = n_{R(NO_3)_n} = \dfrac{0,18}{n}(mol)$
$m_{kết\ tủa} = \dfrac{0,18}{n}.(R + 17n) = \dfrac{0,18}{n}.R + 3,06(2)$
Từ (1)(2) suy ra: $m = 3,76 + 3,06 = 6,82(gam)$
Đáp án D