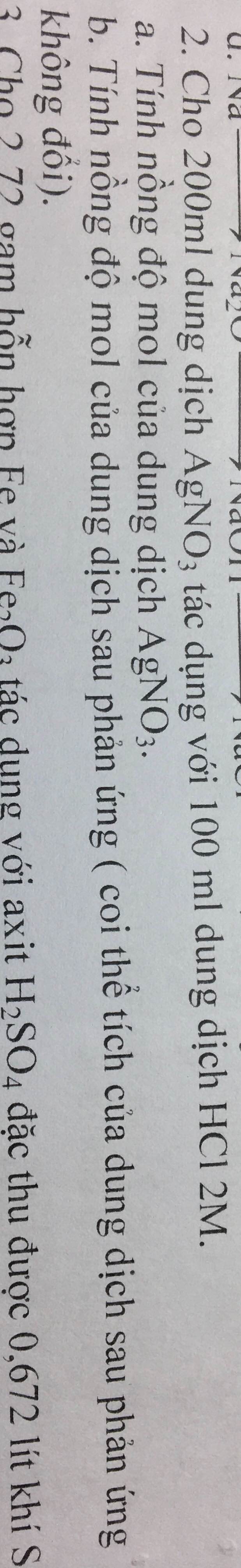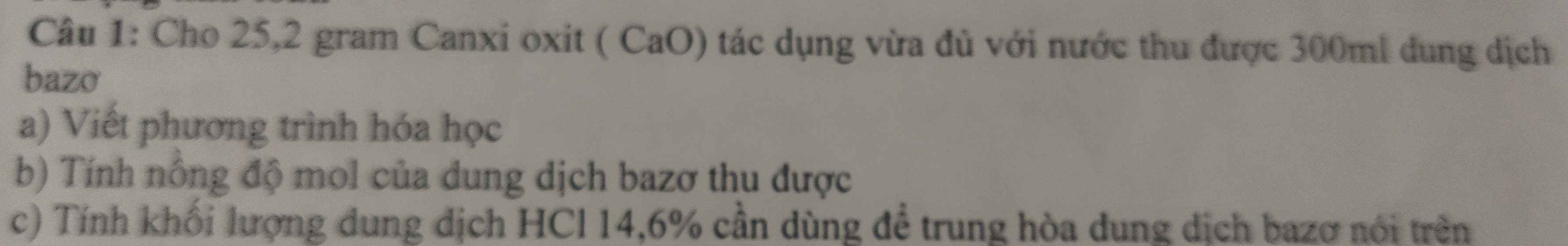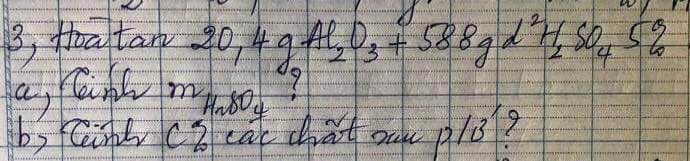Bai 3 :
500ml = 0,5l
300ml = 0,3l
Số mol của dung dịch bạc nitrat
CMAgNO3 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,5=0,5\left(mol\right)\)
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=2.0,3=0,6\left(mol\right)\)
Pt : AgNO3 + HCl → AgCl + HNO3\(|\)
1 1 1 1
0,5 0,6 0,5 0,5
a) Lập tỉ số so sánh : \(\dfrac{0,5}{1}< \dfrac{0,6}{1}\)
⇒ AgNO3 phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol AgNO3
Số mol của bạc clorua
nAgCl = \(\dfrac{0,5.1}{1}=0,5\left(mol\right)\)
Số mol của axit nitric
nHNO3 = \(\dfrac{0,5.1}{1}=0,5\left(mol\right)\)
Thể tích của dung dịch sau phản ứng
Vdung dịch sau phản ứng = 0,5 + 0,3
= 0,8 (l)
Nồng độ mol của bạc clorua
CMAgCl = \(\dfrac{n}{V}=\dfrac{0,5}{0,8}=0,625\left(M\right)\)
Nồng độ mol của axit nitric
CMHNO3 = \(\dfrac{n}{V}=\dfrac{0,5}{0,5}=0,625\left(M\right)\)
b) Khối lượng của dung dịch bạc nitrat
D = \(\dfrac{m}{V}\Rightarrow m=D.V=1,2.500=600\) (g)
Khối lượng của dung dịch axit clohidric
D = \(\dfrac{m}{V}\Rightarrow m=D.V=1,5.300=450\left(g\right)\)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng= mAgNO3 + mHCl - mAgCl
= 600 + 450 - (0,5 . 143,5)
= 978,25 (g)
Khối lượng của bạc clorua
mAgCl = nAgCl . MAgCl
= 0,5 . 143,5
= 71,75 (g)
Khối lượng của axit nitric
mHNO3 = nHNO3 . MHNO3
= 0,5 . 63
= 31,5 (g)
Nồng độ phần trăm của bạc clorua
C0/0AgCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{71,75.100}{978,25}=7,33\)0/0
Nồng độ phần trăm của axit nitric
C0/0HNO3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{31,5.100}{978,25}=3,22\)0/0
Bài 4 : Hình như đề bị thiếu dữ liệu , bạn xem lại giúp mình