Bài 1 :
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{5.588}{100}=29,4\left(g\right)\)
Số mol của axit sunfuric
nH2SO4= \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
Pt : Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O\(|\)
1 3 1 3
0,1 0,3 0,1
a) Số mol của nhôm oxit
nAl2O3 = \(\dfrac{0,3.1}{3}=0,1\left(mol\right)\)
Khối lượng của nhôm oxit
mAl2O3 = nAl2O3 . MAl2O3
= 0,1 . 102
= 10,2 (g)
b) Số mol của nhôm sunfat
nAl2(SO4)3 = \(\dfrac{0,3.1}{3}=0,1\left(mol\right)\)
Khối lượng của nhôm sunfat
mAl2(SO4)3= nAl2(SO4)3 . MAl2(SO4)3
= 0,1 . 342
= 34,2 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng= mAl2O3 + mH2SO4
= 10,2 + 588
= 598,2 (g)
Nồng độ phần trăm của nhôm sunfat
C0/0Al2(SO4)3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{34,2.100}{598,2}=5,72\)0/0
Chúc bạn học tốt
Bài 2 :
Số mol kẽm oxit
nZnO = \(\dfrac{m_{ZnO}}{M_{ZnO}}=\dfrac{20,25}{81}=0,25\left(mol\right)\)
Pt : ZnO + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,25 0,5 0,25
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,5 . 36,5
= 18,25 (g) Khối lượng của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{18,25.100}{6}\) 304,17 (g)
b) Số mol của kẽm clorua
nZnCl2 = \(\dfrac{0,5.1}{2}=0,25\left(mol\right)\)
Khối lượng của kẽm clorua
mZnCl2= nZnCl2 . MZnCl2
= 0,25 . `136
= 34 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng= mZnO + mHCl
= 20,25 + 304,17
= 324,42 (g)
Nồng độ phần trăm của kẽm clorua
C0/0ZnCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{34.100}{324,42}=10,48\)0/0
Chúc bạn học tốt










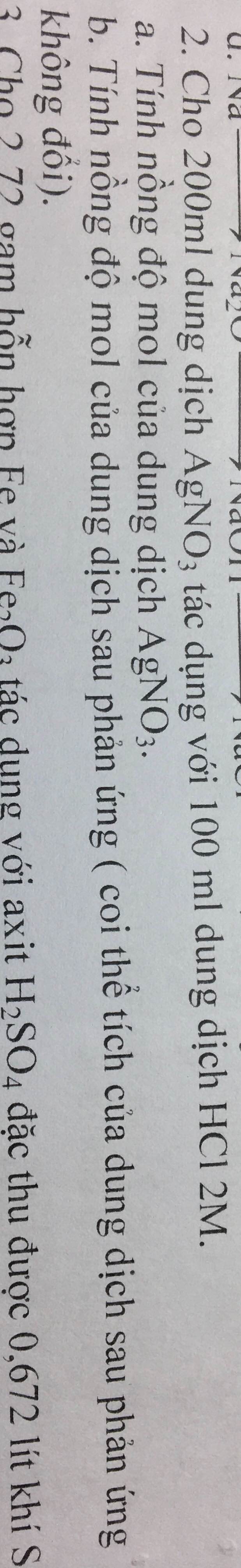

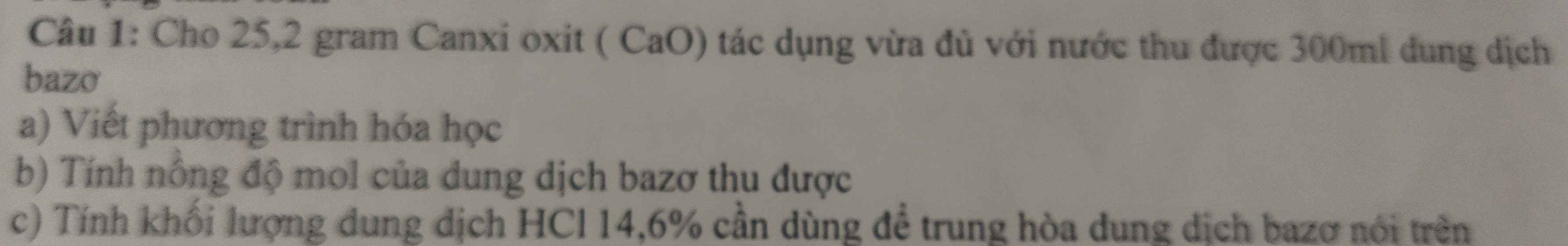
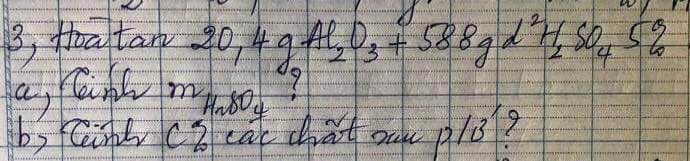





 giúp mình với mình cần gấp ạ
giúp mình với mình cần gấp ạ