Đáp án C
Hằng số tốc độ k chỉ phụ thuộc vào bản chất phản ứng và nhiệt độ phản ứng.
Đáp án C
Hằng số tốc độ k chỉ phụ thuộc vào bản chất phản ứng và nhiệt độ phản ứng.
Có phương trình phản ứng: 2A + B g C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức: v = k[A]2.[B]. Hằng số tốc độ k phụ thuộc vào:
A. Nồng độ của chất
B. Nồng độ của chất B.
C. Nhiệt độ của phản ứng.
D. Thời gian xảy ra phản ứng.
Có phương trình phản ứng: 2A+B → C Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức v = k [ A ] 2 [ B ] Hằng số tốc độ k phụ thuộc:
A. Nồng độ của chất A
B. Nồng độ của chất B
C. Nhiệt độ của phản ứng
D. Thời gian xảy ra phản ứng
Có phương trình phản ứng: 2A + B → C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức v=k[A]2.[B]. Hằng số tốc độ k phụ thuộc:
A. Nồng độ của chất A
B. Nồng độ của chất B
C. Nhiệt độ của phản ứng
D. Thời gian xảy ra phản ứng.
Xét phản ứng: 2 A + B → 2 D Biểu thức tính tốc độ của phản ứng là: v = k [ A ] 2 [ B ] Khi tăng nồng độ chất A thêm 2 lần và giữ nguyên nồng độ chất B thì tốc độ phản ứng
A. giảm 2 lần
B. tăng 2 lần
C. giảm 4 lần
D. tăng 4 lần
Ở nhiệt độ phòng, người ta xác định tốc độ đầu của phản ứng hoá học xảy ra giữa hai chất A và B thu được kết quả sau:
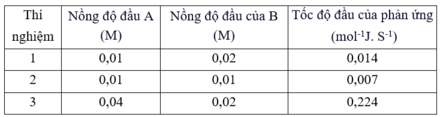
Biểu thức mô tả sự phụ thuộc tốc độ phản ứng vào nồng độ A và B là:
A. v = k. CA. CB
B. v = k. CA2.Cb2
C. v = k. CA2. CB
D. v = k. CA .CB2
Ở nhiệt độ phòng, người ta xác định tốc độ đầu của phản ứng hoá học xảy ra giữa hai chất A và B thu được kết quả sau:
| Thí nghiệm |
Nồng độ đầu A (M) |
Nồng độ đầu của B (M) |
Tốc độ đầu của phản ứng (mol-1J. S-1) |
| 1 |
0,01 |
0,02 |
0,014 |
| 2 |
0,01 |
0,01 |
0,007 |
| 3 |
0,04 |
0,02 |
0,224 |
Biểu thức mô tả sự phụ thuộc tốc độ phản ứng vào nồng độ A và B là:
A. v = k. CA. CB
B. v = k. CA2.Cb2
C. v = k. CA2. CB
D. v = k. CA .CB2
Cho phản ứng : X → Y. Tại thời điểm t1 nồng độ của chất X bằng C1, tại thời điểm t2 (với t2 > t1) nồng độ của chất X bằng C2. Tốc độ trung bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây ?
A. 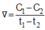
B. 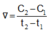
C. 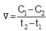
D. 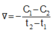
Đại lượng đặc trưng cho đô biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là
A. tốc độ phản ứng.
B. cân bằng hoá học.
C. tốc độ tức thời.
D. quá trình hoá học.
Cho phản ứng A + 2B D C. Nồng độ ban đầu của A là 1M, B là 3M, hằng số tốc độ k = 0,5. Vận tốc của phản ứng khi đã có 20% chất A tham gia phản ứng là:
A. 0,016
B. 2,304
C. 2,704
D. 2,016