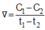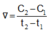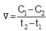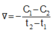Các câu hỏi tương tự
Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là A.
4
,
0
.
10
-
4
m
o
l
/
(
l
.
s
)
B.
7
,
5
....
Đọc tiếp
Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4 , 0 . 10 - 4 m o l / ( l . s )
B. 7 , 5 . 10 - 4 m o l / ( l . s )
C. 1 , 0 . 10 - 4 m o l / ( l . s )
D. 5 , 0 . 10 - 4 m o l / ( l . s )
Cho phương trình hóa học của phản ứng:
X
+
2
Y
→
Z
+
T
Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là A. 4,0.10-4 mol/(l.s). B. 7,5.10-4 mol/(l.s). C. 1,0.10-4 mol/(l.s). D. 5,0.10-4 mol/(l.s).
Đọc tiếp
Cho phương trình hóa học của phản ứng: X + 2 Y → Z + T Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10-4 mol/(l.s).
B. 7,5.10-4 mol/(l.s).
C. 1,0.10-4 mol/(l.s).
D. 5,0.10-4 mol/(l.s).
Cho phản ứng đồng thể diễn ra trong pha khí:
X
+
2
Y
→
X
Y
2
Tốc độ phản ứng được tính theo biểu thức:
v
[
X
]
[
Y
]
2
Cho các biến đổi nồng độ sau: (a) Đồng thời tăng nồng độ X và Y lên 8 lần. (b) Nồng độ cả hai chất đều tăng lên 2 lần. (c) Nồng độ chất X tăng lên 4 lần,...
Đọc tiếp
Cho phản ứng đồng thể diễn ra trong pha khí: X + 2 Y → X Y 2
Tốc độ phản ứng được tính theo biểu thức: v = [ X ] [ Y ] 2 Cho các biến đổi nồng độ sau:
(a) Đồng thời tăng nồng độ X và Y lên 8 lần.
(b) Nồng độ cả hai chất đều tăng lên 2 lần.
(c) Nồng độ chất X tăng lên 4 lần, nồng độ chất Y tăng 2 lần.
(d) Nồng độ chất X giảm 2 lần, chất Y tăng 4 lần.
Số biến đổi làm tốc độ phản ứng tăng lên 8 lần là:
A. 1
B. 2
C. 3
D. 4
Thực hiện phản ứng sau trong bình kín:
C
O
(
k
)
+
C
l
2
(
k
)
→
C
O
C
l
2
(
k
)
Lúc đầu nồng độ
C
l
2
là 0,08 mol/l. Sau 1 phút 20 giây, nồng độ
C
l
2
là 0,024 mol/l. Tính tốc độ trung bình của phản ứng tính theo...
Đọc tiếp
Thực hiện phản ứng sau trong bình kín: C O ( k ) + C l 2 ( k ) → C O C l 2 ( k )
Lúc đầu nồng độ C l 2 là 0,08 mol/l. Sau 1 phút 20 giây, nồng độ C l 2 là 0,024 mol/l. Tính tốc độ trung bình của phản ứng tính theo C l 2 trong khoảng thời gian trên.
Thực hiện phản ứng sau trong bình kín:
H
2
(
k
)
+
B
r
2
(
k
)
→
2
H
B
r
(
k
)
. Lúc đầu nồng độ hơi
B
r
2
là 0,072 mol/l. Sau 2 phút, nồng độ hơi
B
r
2
còn lại là 0,048 mol/l. Tính tốc độ trung bình của p...
Đọc tiếp
Thực hiện phản ứng sau trong bình kín: H 2 ( k ) + B r 2 ( k ) → 2 H B r ( k ) . Lúc đầu nồng độ hơi B r 2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi B r 2 còn lại là 0,048 mol/l. Tính tốc độ trung bình của phản ứng tính theo B r 2 trong khoảng thời gian trên
Cho phản ứng hóa học:
Br
2
+
HCOOH
→
2
HBr
+
CO
2
Lúc đầu nồng độ của HCOOH là 0,010 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là A. 5,0.10-5 mol/(l.s). B. 2,5.10-5 mol/(l.s). C. 2,5.10-4 mol/(l.s). D. 2,0.10-4 mol/(l.s).
Đọc tiếp
Cho phản ứng hóa học: Br 2 + HCOOH → 2 HBr + CO 2
Lúc đầu nồng độ của HCOOH là 0,010 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là
A. 5,0.10-5 mol/(l.s).
B. 2,5.10-5 mol/(l.s).
C. 2,5.10-4 mol/(l.s).
D. 2,0.10-4 mol/(l.s).
Đại lượng đặc trưng cho đô biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là
A. tốc độ phản ứng.
B. cân bằng hoá học.
C. tốc độ tức thời.
D. quá trình hoá học.
Thực hiện phản ứng sau trong bình kín. H2(k) + Br2(k) → 2HBr (k). Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là : A.
8
.
10
-
4
(
mol
/
I
.
s
)
B. 6.10-4 mol/(l.s) C. 4.10-4 mol/(l.s) D. 2.10-4 m...
Đọc tiếp
Thực hiện phản ứng sau trong bình kín. H2(k) + Br2(k) → 2HBr (k). Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là :
A. 8 . 10 - 4 ( mol / I . s )
B. 6.10-4 mol/(l.s)
C. 4.10-4 mol/(l.s)
D. 2.10-4 mol/(l.s)
II-Tự luậnCho phản ứng sau :
H
C
O
O
H
+
B
r
2
→
2
H
B
r
+
C
O
2
Lúc đầu nồng độ hơi
B
r
2
0,04 mol/l. Sau 100 giây, nồng độ hơi
B
r
2
còn lại là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo
B
r...
Đọc tiếp
II-Tự luận
Cho phản ứng sau : H C O O H + B r 2 → 2 H B r + C O 2
Lúc đầu nồng độ hơi B r 2 0,04 mol/l. Sau 100 giây, nồng độ hơi B r 2 còn lại là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo B r 2 trong khoảng thời gian 100 giây