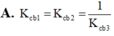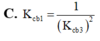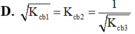\(Ne:..2s^22p^6\) cấu hình bền vững
\(Na:..2s^22p^63s^1\) có electron 3s dễ tách ra khỏi nguyên tử để có cấu hình bền vững của khí hiếm `Ne`
=> \(I_1\left(Na\right)< I_1\left(Ne\right)\)
\(Mg:..2s^22p^63s^2\) có điện tích hạt nhân lớn hơn so với `Na` nên \(I_1\left(Mg\right)>I_1\left(Na\right)\)
Vậy: \(I_1\left(Na\right)=5,14;I_1\left(Mg\right)=7,64\\ I_1\left(Ne\right)=21,58\)
\(Na^+\) có cấu hình có cấu hình bền vững của Ne, trong khi đó \(Ne^+\) có cấu hình kém bền. Sự tách electron ra khỏi cấu hình bền vững của \(Na^+\) đòi hỏi lượng năng lượng I2 lớn hơn I2 của Ne.
\(Mg^+:\left[Ne\right]3s^1\) trong đó thấy electron ở 3s dễ tách ra khỏi nguyên tử để có cấu hình bền vững của Ne nên I2 của Mg nhỏ hơn I2 của Na.
=> \(I_2\left(Mg\right)< 42,79\)