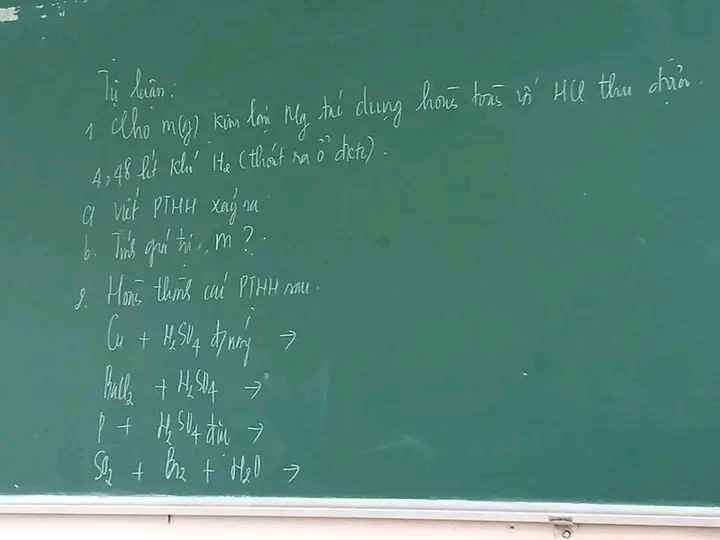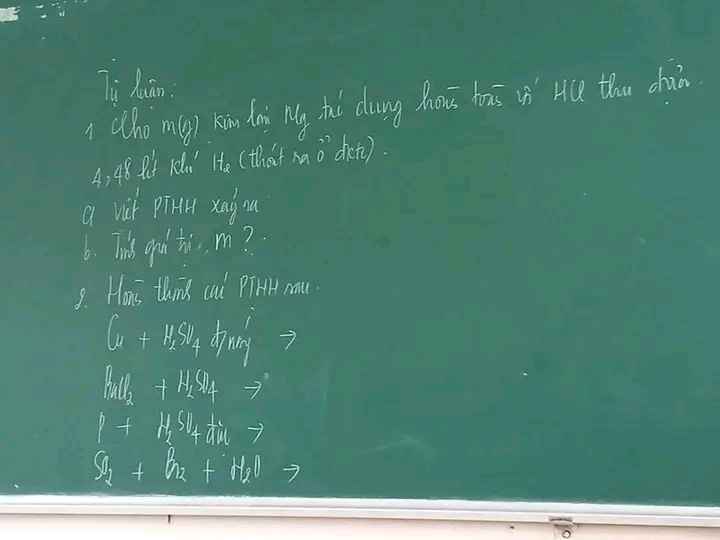1) $n_{Ca} = \dfrac{8}{40} = 0,2(mol) ; n_{HCl} = 0,3(mol)$
$Ca + 2HCl \to CaCl_2 + H_2(1)$
$Ca + 2H_2O \to Ca(OH)_2 + H_2(2)$
$n_{Ca(1)} = n_{CaCl_2} = \dfrac{1}{2}n_{HCl} = 0,15(mol)$
$n_{Ca(2)} = 0,2 - 0,15 = 0,05(mol)$
Suy ra :
$m_{CaCl_2} = 0,15.111 = 16,65(gam)$
$n_{H_2} = n_{Ca(1)} + n_{Ca(2)} = 0,2(mol)$
$V_{H_2} = 0,2.22,4 = 4,48(lít)$
2) $n_{Mg} = \dfrac{6}{24} = 0,25(mol) ; n_{H_2} = 0,2(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
$n_{HCl\ pư} = 2n_{H_2} = 0,4(mol)$
$\Rightarrow x = \dfrac{0,4}{0,5} = 0,8$