Cho từ từ HCl vào dung dịch A chứa a mol Ba(OH)2 và b mol Ba(AlO2)2. Đồ thị biểu diễn số mol Al(OH)3 theo số mol HCl như sau. Nếu cho dung dịch A ở trên tác đụng với 700 ml dung dịch H2SO4 1M thì thu được bao nhiêu gam kết tủa?
Bài 18. Nhôm
Dựa vào đồ thị trên ta chia chúng thành 3 giai đoạn có đánh số thứ tự như sau `H^+ + OH^- -> H_2O \quad (1)`
`H^+ +(AlO_2)^- +H_2O -> Al(OH)_3 \quad (2)`
`3H^+ + Al(OH)_3 -> Al^(3+) +3H_2O \quad (3)`
Giai đoạn `1` : Do xảy ra phản ứng `(1)` nên chưa thấy hiện tượng kết tủa
Giai đoạn `2` : Đồ thị chỉ hướng đi lên do xảy ra phản ứng `(1) ; (2)`
Ta có : `n_(H^+) = 0,6 = n_(OH^-) + n_(Al(OH)_3) = 2a + 0,2= 0,6 -> a = 0,2 (mol)`
Giai đoạn `3` : Đồ thị chỉ hướng đi xuống do kết tủa đã bị hoàn tan `1` phần
`n_(H^+) =n_(AlO_2^-)+ n_(OH^-) + 3n_(Al(OH)_3) = 1,1`
`-> 2(a+b) +3(2b-0,3) = 1,1 -> b = 0,2 (mol)`
`-> n_(Ba(OH)_2) = 0,2 (mol)` ; `n_(Ba(AlO_2)_2) = 0,2 mol`
Nếu cho dung dịch `A` vào ` 0,7 mol H_2SO_4` thì :
`Ba(OH)_2 + H_2SO_4 -> BaSO_4 + 2H_2O`
`n_(H_2SO_4) ` dư `= 0,7 - 0,2 = 0,5 (mol)`
`2H_2O + H_2SO_4 + Ba(AlO_2)_2 ->2 Al(OH)_3 + BaSO_4`
`n_(H_2SO_4) = n_(H_2SO_4) = 0,2 (mol)`
`n_(AlOH)3 = 0,2 . 2 = 0,4 (mol)`
`3H_2SO_4 + 2Al(OH)_3 -> Al_2(SO_4)_3 + 6H_2O`
Do `(n_(H_2SO_4))/3 = (0,5-0,2)/3 = 0,1 < n_(Al(OH)_3) =( 0,4)/2 = 0,2 (mol)`
`-> n_(Al(OH)_3) = 0,4 - 0,3 = 0,1` (mol) `-> m_(Al(OH)_3) = 7,8g`
Đúng 1
Bình luận (2)
Nhỏ từ từ đến dư dung dịch HCl vào dung dịch chứa x mol NaOH và y mol NaAlO2. Kết quả thí nghiệm được biểu diễn bằng đồ thị bên. Xác định tỉ lệ x:y?
Thấy nHCl=0,4 mol có xuất hiện kết tủa
=>x=0,4
Mà nHCl=1 thì kết tủa tan và tan còn lại là 0,2 mol
=>x+4y-3.0,2=1
=>y=0,3
=>x:y=4:3
Đúng 2
Bình luận (3)
Cho từ từ HCl vào dung dịch X chứa a mol Ba(OH)2 và b mol Ba(AlO2)2. Đồ thị biểu diễn số mol Al(OH)3 theo số mol HCl như sau. Nếu cho dung dịch X ở trên tác đụng với 700 ml dung dịch H2SO4 1M thì thu được bao nhiêu gam kết tủa?
nOH-=2a , nAlO2-=2b
Khi kết tủa chưa tan :
nH+=0,6=2a+0,2
Kết tủa tan 1 phần :
nH+=1,1=2a+4.2b-0,3.3=
=>a=b=0,2 mol
nH2SO4=0,82
=>nBaSO4=a+b=0,4
nH+=1,64=2a+8b-2nAl(OH)3
->nAl(OH)3=0,12
=>mkeets tủa =102,56
Đúng 0
Bình luận (2)
Cho m gam hỗn hợp X gồm Al, Fe (có tỉ lệ khối lượng theo thứ tự 3:7) vào 110 gam dung dịch H2SO4 98% (đặc, nóng). Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn (không chứa S), dung dịch Y và 11,2 lít (đktc) hỗn hợp khí SO2, H2S. a. Tính m b. Cho V lít dung dịch NaOH 2M vào dung dịch Y thu được 7,8 gam kết tủa. Tính V
\(m_{phản.ứng}=0,25m\left(g\right)\)
\(m\left(g\right)X\left\{{}\begin{matrix}m_{Al}:0,3m\left(g\right)\\m_{Fe}:0,7m\left(g\right)\end{matrix}\right.\)
Nhận thấy: 0,25m < 0,3m => Al dư, Fe chưa phản ứng
Gọi \(\left\{{}\begin{matrix}n_{SO_2}=a\left(mol\right)\\n_{H_2S}=b\left(mol\right)\end{matrix}\right.\) => \(a+b=\dfrac{11,2}{22,4}=0,5\) (*)
\(n_{H_2SO_4}=\dfrac{110.98\%}{98}=1,1\left(mol\right)\)
PTHH:
\(2Al+6H_2SO_{4\left(đ,n\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(\dfrac{2}{3}a\)<---2a<---------------\(\dfrac{1}{3}a\)<-----------a
\(8Al+15H_2SO_{4\left(đ,n\right)}\rightarrow4Al_2\left(SO_4\right)_3+3H_2S+12H_2O\)
\(\dfrac{8}{3}b\)<---5a<---------------\(\dfrac{4}{3}b\)<-------------b
=> 2a + 5b = 1,1 (**)
Từ (*), (**) => \(\left\{{}\begin{matrix}a=\dfrac{7}{15}\\b=\dfrac{1}{30}\end{matrix}\right.\)
=> \(n_{Al\left(pư\right)}=\dfrac{2}{3}.\dfrac{7}{15}+\dfrac{1}{30}.\dfrac{8}{3}=0,4\left(mol\right)\)
=> m = \(\dfrac{0,4.27}{0,25}=43,2\left(g\right)\)
b) \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\\n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1\left(mol\right)\end{matrix}\right.\)
TH1: Kết tủa không bị hoà tan
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,3<---------0,1
=> \(V=\dfrac{0,3}{2}=0,15\left(l\right)\)
TH2: Kết tủa bị hoà tan 1 phần
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,1----------->0,6----------->0,2
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,1<-------0,1
=> \(V=\dfrac{0,1+0,6}{2}=0,35\left(l\right)\)
Đúng 1
Bình luận (0)
Lấy 93,9 gam hỗn hợp X gồm Fe3O4 và Al. Nung hỗn hợp trong môi trường không có không khí. Sau khi phản ứng xảy ra hoàn toàn, ta được hỗn hợp Y. Chia Y thành 2 phần có khối lượng khác nhau. Phần 1 tác dụng với dung dịch NaOH dư cho 0,672 lít H2 (đktc). Phần 2 tác dụng với dung dịch HC1 dư cho 18,816 lít H2 (đktc). Tính % khối lượng các chất trong hỗn hợp X biết các phản ứng xảy ra hoàn toàn và hiệu suất các phản ứng là 100%.
Đọc tiếp
Lấy 93,9 gam hỗn hợp X gồm Fe3O4 và Al. Nung hỗn hợp trong môi trường không có không khí. Sau khi phản ứng xảy ra hoàn toàn, ta được hỗn hợp Y. Chia Y thành 2 phần có khối lượng khác nhau. Phần 1 tác dụng với dung dịch NaOH dư cho 0,672 lít H2 (đktc). Phần 2 tác dụng với dung dịch HC1 dư cho 18,816 lít H2 (đktc). Tính % khối lượng các chất trong hỗn hợp X biết các phản ứng xảy ra hoàn toàn và hiệu suất các phản ứng là 100%.
Y gồm: $Fe,Al,Al_2O_3$
$3Fe_3O_4 + 8Al \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Phần 1 : $n_{H_2} = 0,03(mol)$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH, $n_{Al} =\dfrac{2}{3}n_{H_2} = 0,02(mol)$
Gọi $n_{Fe} =a (mol) \Rightarrow n_{Al_2O_3} = \dfrac{4}{9}n_{Fe} = \dfrac{4}{9}a(mol)$
Phần 2 :
Gọi $n_{Al} = 0,02x(mol) ; n_{Fe} = ax(mol) ; n_{Al_2O_3} = \dfrac{4}{9}ax(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 0,02x.1,5 + ax = 0,03x + ax = 0,84 \Rightarrow x = \dfrac{0,84}{0,03 + a}(1)$
Ta có :
Bảo toàn nguyên tố với Fe,Al :
\(n_{Fe_3O_4}=\dfrac{a+ax}{3}\left(mol\right)\)
\(n_{Al}=\left(0,02+0,02x\right)+2\left(\dfrac{4}{9}a+\dfrac{4}{9}ax\right)\)(mol)
Suy ra :
\(\dfrac{a+ax}{3}.232+\left(0,02+0,02x+\dfrac{8a}{9}+\dfrac{8ax}{9}\right).27=93,9\)(2)
Thay (1) và (2) suy ra : x = 2,842 ; a = 0,2655
Suy ra :
$m_{Al} = (0,02 + 0,02.2,842 + \dfrac{8.0,2655}{9} + \dfrac{8.2,842.0,2655}{9}).27 = 26,56(gam)$
Đúng 0
Bình luận (2)
Rót từ từ dung dịch HCl 0,1M vào 200 ml dung dịch KAlO2 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V (ml) dung dịch HCl như hình bên dưới. Tính giá trị của a và b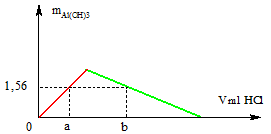
$n_{KAlO_2} = 0,2.0,2 = 0,04(mol)$
Khi dùng $V_{dd\ HCl} = a(ml)$ : Kết tủa chưa đạt max
$KAlO_2 + HCl + H_2O \to Al(OH)_3 + KCl$
$\Rightarrow n_{HCl} = n_{Al(OH)_3} = \dfrac{1,56}{78} = 0,02(mol)$
$\Rightarrow a = \dfrac{0,02}{0,1} = 0,2(lít) =200(ml)$
Khi dùng $V_{dd\ HCl} = b(ml)$ : Kết tủa tan một phần
\(KAlO_2+HCl+H_2O\rightarrow Al\left(OH\right)_3+KCl\)
0,04 0,04 0,04 (mol)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
0,02 0,06 (mol)
$\Rightarrow n_{HCl} = 0,04 + 0,06 = 0,1(mol)$
$\Rightarrow b = \dfrac{0,1}{0,1} = 1(lít) = 1000(ml)$
Đúng 2
Bình luận (0)
\(n_{KAlO_2}=0,2.0,2=0,04\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=\dfrac{1,56}{78}=0,02\left(mol\right)\)
Tại thời điểm có a ml dd HCl phản ứng, KAlO2 dư
PTHH: \(KAlO_2+HCl+H_2O\rightarrow Al\left(OH\right)_3\downarrow+KCl\)
0,02<----0,02<------------0,02
=> \(a=\dfrac{0,02}{0,1}=0,2\left(l\right)=200\left(ml\right)\)
Tại thời điểm có b (ml) dd HCl phản ứng, HCl dư, kết tuat bị hoà tan một phần
PTHH:
\(KAlO_2+HCl+H_2O\rightarrow KCl+Al\left(OH\right)_3\downarrow\)
0,04------>0,04--------------------->0,04
=> \(n_{\downarrow\left(bị.hoà.tan\right)}=0,04-0,02=0,02\left(mol\right)\)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
0,02------->0,06
=> \(b=\dfrac{0,04+0,06}{0,1}=1\left(l\right)=1000\left(ml\right)\)
Đúng 1
Bình luận (0)
Cho 2 dung dịch: dung dịch A (Al2(SO4)3) và dung dịch B (NaOH) đều chưa biết nồng độ. - TN1: Trộn 100ml dung dịch A với 120ml dung dịch B, được kết tủa, sau khi nung được chất rắn có khối lượng 2,04 gam. - TN2: Trộn 100ml dung dịch A với 200ml dung dịch B, lấy kết tủa đem nung ta được 2,04 gam chất rắn. a) Chứng tỏ rằng trong TN1, Al(OH)3 chưa tan trở lại, xác định nồng độ mol của 2 dung dịch A và B. b) Phải thêm vào 100ml dung dịch A bao nhiêu ml dung dịch B để cho chất rắn thu được sau khi nun...
Đọc tiếp
Cho 2 dung dịch: dung dịch A (Al2(SO4)3) và dung dịch B (NaOH) đều chưa biết nồng độ. - TN1: Trộn 100ml dung dịch A với 120ml dung dịch B, được kết tủa, sau khi nung được chất rắn có khối lượng 2,04 gam. - TN2: Trộn 100ml dung dịch A với 200ml dung dịch B, lấy kết tủa đem nung ta được 2,04 gam chất rắn. a) Chứng tỏ rằng trong TN1, Al(OH)3 chưa tan trở lại, xác định nồng độ mol của 2 dung dịch A và B. b) Phải thêm vào 100ml dung dịch A bao nhiêu ml dung dịch B để cho chất rắn thu được sau khi nung kết tủa có khối lượng 1,224 gam.
a) Dù dùng $V_{dd\ B\ ở\ TN2} > V_{dd\ B\ ở\ TN1}$ mà lượng kết tủa thu được vẫn bằng nhau. Suy ra : ở TN1, kết tủa chưa đạt tối đa, tức là $Al(OH)3$ chưa bị hòa tan trở lại.
Gọi $C_{M_A} = a(M) ; C_{M_B} = b(M)$
$n_{Al_2O_3} = 0,02 \Rightarrow n_{Al(OH)_3} = 0,04(mol)$
TH1 :
$Al_2(SO_4)_3 + 6NaOH \to 2Al(OH)_3 + 3Na_2SO_4$
$n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al(OH)_3} = 0,06(mol) \Rightarrow ba= \dfrac{0,06}{0,1} = 0,6M$
TN2 :
\(Al_2\left(SO_4\right)_3+6NaOH\text{→}2Al\left(OH\right)_3+3Na_2SO_4\)
0,06 0,36 0,12 (mol)
\(Al\left(OH\right)_3+NaOH\text{→}NaAlO_2+2H_2O\)
0,08 0,08 (mol)
$\Rightarrow n_{NaOH} = 0,36 + 0,08 = 0,44(mol) \Rightarrow b =\dfrac{0,44}{0,2} = 2,2M$
b)
$n_{Al_2O_3} = 0,012(mol) \Rightarrow n_{Al(OH)_3} = 0,024(mol)$
\(Al_2\left(SO_4\right)_3+6NaOH\text{→}2Al\left(OH\right)_3+3Na_2SO_4\)
0,06 0,36 0,12 (mol)
\(Al\left(OH\right)_3+NaOH\text{→}NaAlO_2+2H_2O\)
0,096 0,096 (mol)
$n_{NaOH} = 0,36 + 0,096 = 0,456 \Rightarrow V_{dd\ B} =\dfrac{0,456}{2,2} = 0,207(lít)$
Đúng 1
Bình luận (1)
Cho đồng thời 1 lít HCl 2M, vào 1 lít hỗn hợp Na2CO3 1M và NaHCO3 1M thì ta sẽ thu được bao nhiêu lít khí (đktc)?
$n_{HCl} = 1.2 = 2(mol)$
$n_{Na_2CO_3} = n_{NaHCO_3} = 1(mol)$
Gọi $n_{Na_2CO_3\ pư} = n_{NaHCO_3\ pư} = 1.a = a(mol)$
$Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O$
$NaHCO_3 + HCl \to NaCl + CO_2 + H_2O$
Theo PTHH, $n_{HCl} = a.2 + a = 3a = 2 \Rightarrow a = \dfrac{2}{3}$
$n_{CO_2} = a + a = 2a = \dfrac{2}{3}.2 = \dfrac{4}{3}(mol)$
$\Rightarrow V_{CO_2} =\dfrac{4}{3}.22,4 = 29,867(lít)$
Đúng 0
Bình luận (1)
Hấp thụ 4,48 lít CO2 (đktc) vào 0,5 lít NaOH 0,4M và KOH 0,2M. Sau phản ứng được dung dịch X. Lấy 1/2 X tác dụng với Ba(OH)2 dư, tạo m gam kết tủa. Tính m và tổng khối lượng muối khan sau khi cô cạn dung dịch X.
$n_{CO_2} =\dfrac{4,48}{22,4} = 0,2(mol)$
$n_{NaOH} = 0,5.0,4 = 0,2(mol) ; n_{KOH} = 0,5.0,2 = 0,1(mol)$
$\Rightarrow n_{OH^-} = 0,2 + 0,1 = 0,3(mol)$
\(2OH^-+CO_2\rightarrow CO_3^{2-}+H_2O\)
0,3 0,15 0,15 (mol)
\(CO_3^{2-}+CO_2+H_2O\rightarrow2HCO_3^-\)
0,05 0,05 0,1 (mol)
Suy ra, X gồm :
$CO_3^{2-} : 0,15 - 0,05 = 0,1(mol)$
$HCO_3^- : 0,1(mol)$
$Na^+ : 0,2$
$K^+ : 0,1$
$\Rightarrow m_{muối} = 0,1.60 + 0,1.61 + 0,2.23 + 0,1.39 = 20,6(gam)$
1/2 X gồm :
$CO_3^{2-} : 0,05(mol)$
$HCO_3^- : 0,05(mol)$
$HCO_3^- + OH^- \to CO_3^{2-} + H_2O$
$CO_3^{2-} + Ba^{2+} \to BaCO_3$
$n_{BaCO_3} = n_{CO_3^{2-}} + n_{HCO_3^-} = 0,1(mol)$
$m = 0,1.197 = 19,7(gam)$
Đúng 0
Bình luận (1)
Xác định công thức hóa học của A, B, C, E, F (đều là hợp chất của Al) thỏa mãn các chuyển hóa sau và viết các phương trình hóa học thực hiện các chuyển hóa đó.
$A : Al_2O_3 ; C : Al_2(SO_4)_3 ; B :AlCl_3 ; E : Al(OH)_3 ; F : Al(NO_3)_3$
$(1) 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$(2) Al_2O_3 + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2O$
$(3) Al_2(SO_4)_3 + 6NaOH \to 2Al(OH)_3 + 3Na_2SO_4$
$(4) Al(OH)_3 + 3HNO_3 \to Al(NO_3)_3 + 3H_2O$
$(5) Al(NO_3)_3 + 3KOH \to Al(OH)_3 + 3KNO_3$
$(6) Al_2O_3 + 6HNO_3 \to 2Al(NO_3)_3 + 3H_2O$
$(7) 2Al(OH)_3 \xrightarrow{t^o} Al_2O_3 + 3H_2O$
$(8) 2Al + 6HCl \to 2AlCl_3 + 3H_2$
$(9) AlCl_3 +4NaOH \to NaAlO_2 + 3NaCl + 2H_2O$
$(10) NaAlO_2 + 2H_2O + CO_2 \to Al(OH)_3 + NaHCO_3$
Đúng 1
Bình luận (0)
A: Al2(SO4)3
B: Al2O3
C: AlCl3
E: Al(OH)3
F: Al(NO3)3
(1) `2Al + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2`
(2) `Al_2(SO_4)_3 + 3BaCl_2 -> 2AlCl_3 + 3BaSO_4`
(3) `AlCl_3 + 3NaOH -> Al(OH)_3 + 3NaCl`
(4) `Al(OH)_3 + 3HNO_3 -> Al(NO_3)_3 + 3H_2O`
(5) `Al(NO_3)_3 + 3KOH -> Al(OH)_3 + 3KNO_3`
(6) `Al_2(SO_4)_3 + 3Ba(OH)_2 -> 2Al(OH)_3 + 3BaSO_4`
(7) `2Al(OH)_3 + 3H_2SO_4 -> Al_2(SO_4)_3 + 6H_2O`
(8) `4Al + 3O_2 -> (t^o) 2Al_2O_3`
(9) `Al_2O_3 + 2NaOH -> 2NaAlO_2 + H_2O`
(10) `NaAlO_2 + HCl + H_2O -> Al(OH)_3 + NaCl`
Đúng 0
Bình luận (0)









