$n_{KAlO_2} = 0,2.0,2 = 0,04(mol)$
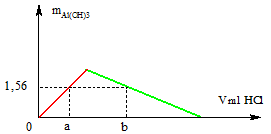
Khi dùng $V_{dd\ HCl} = a(ml)$ : Kết tủa chưa đạt max
$KAlO_2 + HCl + H_2O \to Al(OH)_3 + KCl$
$\Rightarrow n_{HCl} = n_{Al(OH)_3} = \dfrac{1,56}{78} = 0,02(mol)$
$\Rightarrow a = \dfrac{0,02}{0,1} = 0,2(lít) =200(ml)$
Khi dùng $V_{dd\ HCl} = b(ml)$ : Kết tủa tan một phần
\(KAlO_2+HCl+H_2O\rightarrow Al\left(OH\right)_3+KCl\)
0,04 0,04 0,04 (mol)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
0,02 0,06 (mol)
$\Rightarrow n_{HCl} = 0,04 + 0,06 = 0,1(mol)$
$\Rightarrow b = \dfrac{0,1}{0,1} = 1(lít) = 1000(ml)$
\(n_{KAlO_2}=0,2.0,2=0,04\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=\dfrac{1,56}{78}=0,02\left(mol\right)\)
Tại thời điểm có a ml dd HCl phản ứng, KAlO2 dư
PTHH: \(KAlO_2+HCl+H_2O\rightarrow Al\left(OH\right)_3\downarrow+KCl\)
0,02<----0,02<------------0,02
=> \(a=\dfrac{0,02}{0,1}=0,2\left(l\right)=200\left(ml\right)\)
Tại thời điểm có b (ml) dd HCl phản ứng, HCl dư, kết tuat bị hoà tan một phần
PTHH:
\(KAlO_2+HCl+H_2O\rightarrow KCl+Al\left(OH\right)_3\downarrow\)
0,04------>0,04--------------------->0,04
=> \(n_{\downarrow\left(bị.hoà.tan\right)}=0,04-0,02=0,02\left(mol\right)\)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
0,02------->0,06
=> \(b=\dfrac{0,04+0,06}{0,1}=1\left(l\right)=1000\left(ml\right)\)







![Madridista [zombiev4]](https://hoc24.vn/images/avt/avt2225746_256by256.jpg)






