\(S+O_2\rightarrow\left(t^o\right)SO_2\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ 2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
Oxit axit: SO2, CO2
Oxit bazo: Fe3O4, MgO
\(S+O_2\rightarrow\left(t^o\right)SO_2\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ 2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
Oxit axit: SO2, CO2
Oxit bazo: Fe3O4, MgO
Viết các phương trình hóa học của S, C, Cu, Zn với khí O₂. Cho biết các oxit tạo thành thuộc loại nào. Viết công thức các axit hoặc bazơ tương ứng với mỗi oxit đó
Gọi tên các oxit sau và phân loại chúng: P2O5, FeO, SO2, P2O3, Fe2O3, CaO, CO2, Na2O, Fe3O4, MgO, SiO2.
1) Phân loại các oxit trên thành oxit axit, oxit bazơ.
2) Gọi tên các oxit trên.
3) Viết phương trình hóa học điều chế mỗi oxit trên bằng cách đốt các đơn chất tương ứng trong khí oxi.
Câu 4: Viết được các phương trình hóa học hỗn hợp kim loại, oxit bazơ tác dụng với dung dịch axit. [4]; Tính % về khối lượng của hỗn hợp kim loại, oxit bazơ tác dụng với dung dịch axit. Tính nồng độ mol của dung dịch sau phản ứng. [4] Hướng dẫn Bước 1: Tóm tắt dữ kiện của bài toán Bước 2: Đổi số liệu về số mol và viết PTPƯ Bước 3. Gọi x, y là số mol lần lượt của chất phản ứng thứ nhất và thứ hai (x, y >0). Từ hai ẩn số x, y kết hợp với dữ kiện bài toán lập hệ phương trình bậc nhất hai ẩn. Giải hệ phương trình tìm được ẩn x, y. Bước 4. Tính toán theo yêu cầu của bài toán 4.1. Hòa tan hoàn toàn 11,9 gam hỗn hợp X gồm hai kim loại Al và Zn vào 500 ml dung dịch axit sunfuric, thu được 8,96 lít khí ở đktc. a) Viết phương trình hóa học của các phản ứng xảy ra. b) Tính phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp X. c) Tính nồng độ mol dung dịch axit sunfuric vừa đủ hòa tan hết lượng hỗn hợp kim loại trên. 4.2. Hòa tan hoàn toàn 8 gam hỗn hợp gồm 2 kim loại Fe và Mg bằng dung dịch H2SO4 20% (vừa đủ). Sau phản ứng thu được dung dịch X và giải phóng 4,48 lít khí (đktc). a. Tính thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu. b. Tính khối lượng dung dịch H2SO4 đã dùng. 4.3. Cho 9,6 (g) hỗn hợp gồm Mg và MgO tác dụng với 150 (g) dung dịch axit Clohidric HCl sau phản ứng thu được 3,36 (l) khí Hidro (đktc). 1) Viết các phương trình phản ứng xảy ra. 2) Tính thành phần phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu. 3) Tính nồng độ phần trăm dung dịch axit Clohidric đã dùng.
Bài 1. Viết công thức hóa học tạo bởi các thành phần tương ứng vào ô trống
Nguyên tố↓ | O | OH | NO3 | SO4 | CO3 | Cl |
Na |
|
|
|
|
|
|
Fe(III) |
|
|
|
|
|
|
K |
|
|
|
|
|
|
Ca |
|
|
|
|
|
|
Al |
|
|
|
|
|
|
Fe(II) |
|
|
|
|
|
|
Mg |
|
|
|
|
|
|
Phân loại các công thức mới viết trong bảng trên(basic oxide , muối ,base)
Bài 2. Viết công thức hóa học tạo bởi các thành phần tương ứng vào ô trống
| Cl | Br | I | F | NO3 | SO4 | CO3 | PO4 | S(II) |
H |
|
|
|
|
|
|
|
|
|
Các công thức mới viết thuộc loại hợp chất nào?
Bài 3.
a/Viết 5 công thức hóa học acidic oxide(oxit axit-vn)
b/Viết 5 công thức hóa học basic oxide(oxit bazơ-vn)
c/Viết 5 công thức hóa học acid.
d/Viết 5 công thức hóa học base tan trong nước (kiềm)và . 5 công thức hóa học base không tan trong nước.
e/ Viết 10 công thức hóa học muối.
Bài 4. Hoàn thành các phương trình sau
1/ K2O + H2O ![]() ...
...
2/ ........... + ..........![]() NaOH
NaOH
3/ ........... + ..........![]() Ca(OH)2
Ca(OH)2
4/ ........... + ..........![]() Ba(OH)2
Ba(OH)2
5/ K + H2O ![]()
6/ Na + H2O ![]()
7/ Ca + H2O ![]()
8/ Ba + H2O ![]()
9/ CO2 + H2O ![]()
10/ SO2 + H2O ![]()
11/ CO2 + H2O ![]()
12/ SO2 + H2O ![]()
13/ HCl + Fe ![]() ...............+ .........
...............+ .........
14/ HCl + Al ![]() ...............+ .........
...............+ .........
15/ H2SO4 + Mg ![]() ...............+ .........
...............+ .........
16/ H2SO4 + Zn ![]() ...............+ .........
...............+ .........
17/ H2SO4 + Al ![]() ...............+ .........
...............+ .........
18/ Ca + O2 ![]() ............
............
19/ Al + O2 ![]() ............
............
20/ Fe + O2 ![]() ............
............
21/ P + O2 ![]() ............
............
22/ CH4 + O2 ![]() ............+ .......
............+ .......
23/ H2 + CuO ![]() ............+ .......
............+ .......
24/ HCl + Fe2O3 ![]() ............+ .......
............+ .......
25/ HCl + FeO ![]() ............+ .......
............+ .......
Bài 5. Hoàn thành chuỗi phản ứng sau
1/ H2 ![]() H2O
H2O ![]() H2SO4
H2SO4 ![]() FeSO4
FeSO4
2/ H2 ![]() H2O
H2O ![]() H2SO4
H2SO4 ![]() Al2(SO4)3
Al2(SO4)3
3/ Na ![]() Na2O
Na2O ![]() NaOH
NaOH
4/ Ca ![]() CaO
CaO ![]() Ca(OH)2
Ca(OH)2
5/ Ba ![]() BaO
BaO ![]() Ba(OH)2
Ba(OH)2
Bài 1. Viết công thức hóa học tạo bởi các thành phần tương ứng vào ô trống
Nguyên tố↓ | O | OH | NO3 | SO4 | CO3 | Cl |
Na |
|
|
|
|
|
|
Fe(III) |
|
|
|
|
|
|
K |
|
|
|
|
|
|
Ca |
|
|
|
|
|
|
Al |
|
|
|
|
|
|
Fe(II) |
|
|
|
|
|
|
Mg |
|
|
|
|
|
|
Phân loại các công thức mới viết trong bảng trên(basic oxide , muối ,base)
Bài 2. Viết công thức hóa học tạo bởi các thành phần tương ứng vào ô trống
| Cl | Br | I | F | NO3 | SO4 | CO3 | PO4 | S(II) |
H |
|
|
|
|
|
|
|
|
|
Các công thức mới viết thuộc loại hợp chất nào?
Bài 12. Cho biết các chất sau đây thuộc hợp chất nào và viết công thức hóa học của các hợp chất đó: natri hidroxit, khí cacbonic, khí sunfurơ, sắt (III) oxit, muối ăn,axit clohidric, axit photphoric, kali cacbonat, canxi sunfat, nhôm hidroxit, natri photphat, sắt (III) hidroxit, natri hidrosunfat, canxi hidrocacbonat, natri đihidrophotphat, magie photphat, kẽm nitrat.
Cho dãy chuyển hóa sau:
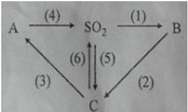
Hãy xác định công thức hóa học của A, B, C sao cho phù hợp và viết các phương trình hóa học minh họa, ghi rõ điều kiện phản ứng (nếu có). Biết A là muối axit, B là oxit axit, C là axit mạnh.
1. thế nào là phản ứng trao đổi? viết 3 phương trình hóa học minh họa?
2. tính chất hóa học đặo trưng ( khác so với axit ) của H2SO4 đặc.
3. tính chất hóa học của các hợp chất: Oxit, Axit, Bazơ, Muối.
4. điều chế 1 số hợp chất quan trong: SO2, CaO, H2SO4, Ca(OH)2, NaCL.
5. pha chế dung dịch H2SO4 loãng từ dung dịch H2SO4 đặc.
6. pha chế dung dịch Ca(OH)2 từ CaO.
7. hiện tượng 1 số thí nghiệm:
a. cho dd NaSO4 vào dd BaCL2.
b. cho dd Na2CO3 vào dd HCL.
c. đinh sắt cho vào dd CuSO4.
d. cho dd H2SO4 vào dd BaCL2.
e. cho dd H2SO4 đặc vào đường saccarozơ.
f. cho dd ALCL3 vào dd NaOH ( có dư).
g. cho nước cất vào CaO, sau đó cho dd phenolphtalein.
cho dd NaCO4 vào dd CaCL2.
( cần gấp ạ)
Có những muối sau : CaCO 3 , CuSO 4 , MgCl 2 Hãy cho biết muối nào có thể điều chế bằng phương pháp sau : Oxit bazơ tác dụng với oxit axit. Viết các phương trình hoá học.