200ml = 0,2l
\(n_{HCl}=2.0,2=0,4\left(mol\right)\)
Pt : \(MnO_2+4HCl_{đặc}\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O|\)
1 4 1 1 2
0,1 0,4
\(n_{MnO2}=\dfrac{0,4.1}{4}=0,1\left(mol\right)\)
⇒ \(m_{MnO2}=0,1.87=8.7\left(g\right)\)
Chúc bạn học tốt
200ml = 0,2l
\(n_{HCl}=2.0,2=0,4\left(mol\right)\)
Pt : \(MnO_2+4HCl_{đặc}\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O|\)
1 4 1 1 2
0,1 0,4
\(n_{MnO2}=\dfrac{0,4.1}{4}=0,1\left(mol\right)\)
⇒ \(m_{MnO2}=0,1.87=8.7\left(g\right)\)
Chúc bạn học tốt
Cho sơ đồ điều chế khí clo trong phòng thí nghiệm. Hóa chất trong các bình (1), (2), (3), (4) lần lượt là (chọn 1 đáp án đúng)
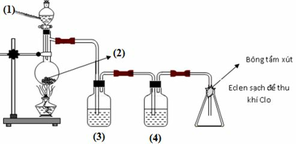
A. NaCl, MnO2, HCl đặc, H2SO4 đặc
B. NaCl, H2SO4 đặc, MnO2, HCl đặc
C. HCl đặc, MnO2, NaCl, H2SO4 đặc
D. H2SO4 đặc, MnO2, HCl đặc, NaCl
Hình vẽ 3.5 là thiết bị điều chế khí clo trong phòng thí nghiệm.
X và Y là những chất nào trong số các chất sau ?
X : H 2 O , dd HCl, dd H 2 SO 4 , dd NaOH, dd NaCl.
Y : NaCl, CaCO 3 , Mn O 2 , Cu Cl 2 , Na 2 SO 4 , KMn O 4
Viết phương trình hoá học điều chế khí clo từ những chất đã chọn ở trên.
Viết phương trình hóa học điều chế khí clo từ M n O 2 , HCl, NaCl
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl. a) Hãy viết phương trình phản ứng điều chế khí Cl2 (ghi rõ điều kiện). b) Giải thích tác dụng của bình (1) (đựng dung dịch NaCl bão hòa); bình (2) (đựng dung dịch H2SO4 đặc) và nút bông tẩm dung dịch NaOH ở bình (3)
Trong một buổi làm thí nghiệm ban Như tiến hành thí nghiệm như sau: cho 200ml dung dịch KOH 2M vào 200ml dung dịch HCl thì phan ứng xảy ra vừa đủ.Nong độ mol của HCl trong dung dịch mà bạn Như đã dùng là bao nhiêu?
Câu 1. Để điều chế khí hiđro trong phòng thí nghiệm, ta có thể dùng kim loại nhôm tác dụng với:
A. CuSO4 hoặc HCl loãng. B. H2SO4 loãng hoặc HCl loãng.
C. Fe2O3 hoặc CuO. D. KClO3 hoặc KMnO4.
Câu 2. Phản ứng nào sau đây không được dùng để điều chế hiđro trong phòng thí nghiệm?
A. Zn + 2HCl → ZnCl2 + H2. B. Fe + H2SO4 → FeSO4 + H2.
C. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2. D. 2H2O 2H2 + O2.
Câu 3. Phản ứng hóa học giữa đơn chất và hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất gọi là:
A. Phản ứng oxi hóa – khử. B. Phản ứng hóa hợp.
C. Phản ứng thế. D. Phản ứng phân hủy.
Câu 4. Phản ứng nào dưới đây là phản ứng thế?
A. 2KClO3 KCl + O2. B. SO3 + H2O H2SO4.
C. Fe2O3 + 6HCl 2FeCl3 + 3H2O. D. Fe3O4 + 4H2 3Fe + 4H2O.
Câu 5. Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2 Cu + H2O. B. Mg + 2HCl MgCl2 + H2.
C. Ca(OH)2 + CO2 CaCO3 + H2O. D. Zn + CuSO4 ZnSO4 + Cu.
Câu 6. Phản ứng nào sau đây không phải là phản ứng thế?
A. Fe + CuCl2 → FeCl2 + Cu. B. 2Al + 6HCl → 2AlCl3 + 3H2.
C. 2Mg + O2 → 2MgO. D. Fe + H2SO4 → H2 + FeSO4.
Câu 7. Phản ứng được sử dụng để điều chế khí hiđro trong phòng thí nghiệm là
A. Zn + 2HCl → ZnCl2 + H2
B. 2CH4 C2H2 + 3H2
C. 2H2O 2H2 + O2
D. C + H2O (hơi) CO + H2
Câu 8. Phản ứng nào dưới đây thuộc loại phản ứng thế?
A. FeO + 2HCl ® FeCl2 + H2O
B. 2Al + 3CuSO4 ® Al2(SO4)3 + 3Cu
C. P2O5 + 3H2O® 2H3PO4
D. Fe(OH)3 + 3HNO3 ® Fe(NO3)3 + 3H2O
Câu 9. Cho các chất sau: Cu, H2SO4, CaO, Mg, S, O2, NaOH, Fe. Các chất dùng để điều chế khí hiđro H2 là:
A. Cu, H2SO4, CaO. B. Mg, NaOH, Fe. C. H2SO4, S, O2. D. H2SO4, Mg, Fe.
Câu 10. Phát biểu nào sau đây là đúng?
A. Phương trình hóa học: 2Fe + 3Cl2 ® 2FeCl3 thuộc loại phản ứng phân hủy.
B. Phương trình hóa học: 2H2O ® 2H2↑ + O2↑ thuộc loại phản ứng hóa hợp.
C. Phương trình hóa học: CuSO4 + Fe ® FeSO4 + Cu thuộc loại phản ứng thế.
D. Phương trình hóa học: Fe + H2SO4 ® FeSO4 + H2↑ thuộc loại phản ứng phân hủy.
Câu 11. Một học sinh thực hiện 3 cách thu khí hiđro vào ống nghiệm được mô tả như hình dưới đây:
Cách nào không dùng để thu khí hiđro?
A. Cách 1. B. Cách 2.
C. Cách 3. D. Cách 1 và cách 3.
Câu 12. Cho Zn vào ống nghiệm chứa dung dịch axit clohidric. Dẫn khí sinh ra đi qua ống chữ V chứa bột đồng (II) oxit đang nung nóng. Thí nghiệm mô tả như hình bên. Hiện tượng quan sát được là
A. Kẽm tan dần, dung dịch trong ống nghiệm sủi bọt khí.
B. Bột đồng (II) oxit chuyển dần từ màu đen sang đỏ gạch.
C. Có những giọt nước đọng trong ống thủy tinh chữ V.
D. Tất cả các hiện tượng trên.
Câu 13. Cho các cặpchất: (Na, H2O), (Na2O, H2O), (Ba, H2O), (Zn, HCl), (Al, H2SO4), (Fe, H2O). Số cặp chất tác dụng được với nhau ở nhiệt độ thường sinh ra khí hiđro là
A. 3. B. 4. C. 5. D. 6.
Câu 14. Cho các phản ứng sau:
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓; (2) Na2O + H2O → 2NaOH;
(3) Fe + 2HCl → FeCl2 + H2↑; (4) CuO + 2HCl → CuCl2 + H2O;
(5) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑; (6) Mg + CuCl2 → MgCl2 + Cu↓;
(7) CaO + CO2 → CaCO3; (8) HCl + NaOH → NaCl + H2O.
Số phản ứng thuộc loại phản ứng thế là
A. 3. B. 4. C. 5. D. 6.
Để loại khí HCl thoát ra cùng với khí C l 2 trong phản ứng M n O 2 + 4 H C l → t o M n C l 2 + C l 2 + 2 H 2 O người ta dùng
A. dung dịch NaOH
B. dung dịch NaCl bão hòa
C. H 2 S O 4 đặc
D. dung dịch nước vôi trong
Từ M n O 2 , dung dịch H C l , K C l O 3 và cacbon, viết phương trình hóa học để điều chế các khí: clo, oxi, cacbon đioxit.
4. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Để điều chế được 2,32g Fe3O4 cần dùng:
a) Bao nhiêu gam sắt? b) Bao nhiêu lít khí O2 (ở đktc)?