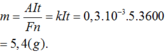Các câu hỏi tương tự
Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken, dòng điện chạy qua có cường độ 5 A trong thời gian 1 giờ. Biết đương lượng điện hóa của niken là k
0
,
3
.
10
-
3
g/C. Khối lượng niken giải phóng ở catot là
0
,
3
.
10
-
3
A. 5,40 kg B. 1,50 g C. 5,40 g D. 5,40 mg
Đọc tiếp
Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken, dòng điện chạy qua có cường độ 5 A trong thời gian 1 giờ. Biết đương lượng điện hóa của niken là k = 0 , 3 . 10 - 3 g/C. Khối lượng niken giải phóng ở catot là 0 , 3 . 10 - 3
A. 5,40 kg
B. 1,50 g
C. 5,40 g
D. 5,40 mg
Một bình điện phân chứa dung dịch muối của niken với hai điện cực bằng niken (A58, n2). Cho dòng điện có cường độ 6A chạy qua bình điện phân thì trong khoảng thời gian 30 phút lượng niken bám vào catôt là A. 3,24 kg B. 3,24 mg C. 0,9 g D. 3,24 g
Đọc tiếp
Một bình điện phân chứa dung dịch muối của niken với hai điện cực bằng niken (A=58, n=2). Cho dòng điện có cường độ 6A chạy qua bình điện phân thì trong khoảng thời gian 30 phút lượng niken bám vào catôt là
A. 3,24 kg
B. 3,24 mg
C. 0,9 g
D. 3,24 g
Biết đương lượng điện hóa của Niken là k 3.10 – 4 g/C. Khi cho một điện lượng 10 C chạy qua bình điện phân có anốt làm bằng niken thì khối lượng niken bám vào catốt là A. 0,3.
10
–
4
g. B. 10,3.
10
–
4
g. C. 3.
10...
Đọc tiếp
Biết đương lượng điện hóa của Niken là k = 3.10 – 4 g/C. Khi cho một điện lượng 10 C chạy qua bình điện phân có anốt làm bằng niken thì khối lượng niken bám vào catốt là
A. 0,3. 10 – 4 g.
B. 10,3. 10 – 4 g.
C. 3. 10 - 3 g.
D. 0,3. 10 - 3 g
Một tấm kim loại có diện tích 120
cm
2
đem mạ niken được làm catot của bình điện phân dung dịch muối niken có anot làm bằng niken. Tính bề dày của lớp niken được mạ biết dòng điện qua bình điện phân có cường độ 0,3A chạy qua trong 5 giờ, niken có A58,7; n2; D8,8.
10
3
kg
/
m
3
. A. 0,021mm. B. 0,0155mm. C. 0,012mm. D. 0,0321mm.
Đọc tiếp
Một tấm kim loại có diện tích 120 cm 2 đem mạ niken được làm catot của bình điện phân dung dịch muối niken có anot làm bằng niken. Tính bề dày của lớp niken được mạ biết dòng điện qua bình điện phân có cường độ 0,3A chạy qua trong 5 giờ, niken có A=58,7; n=2; D=8,8. 10 3 kg / m 3 .
A. 0,021mm.
B. 0,0155mm.
C. 0,012mm.
D. 0,0321mm.
Mạ kền (Niken) cho một bề mặt kim loại có diện tích 40
c
m
2
bằng điện phân. Sau 30 phút bề dày của lớp kền là 0,03 mm. Biết nguyên tử lượng Ni 58, hóa trị 2, khối lượng riêng D
8
,
9
.
10
3
k
g
/
m
3
. Dòng điện qua bình điện phân có cường độ là A. 3 A. B. 1,97 A. C. 2,5 A D. 1,5 A
Đọc tiếp
Mạ kền (Niken) cho một bề mặt kim loại có diện tích 40 c m 2 bằng điện phân. Sau 30 phút bề dày của lớp kền là 0,03 mm. Biết nguyên tử lượng Ni = 58, hóa trị 2, khối lượng riêng D = 8 , 9 . 10 3 k g / m 3 . Dòng điện qua bình điện phân có cường độ là
A. 3 A.
B. 1,97 A.
C. 2,5 A
D. 1,5 A
Mạ kền (Niken) cho một bề mặt kim loại có diện tích
40
c
m
2
bằng điện phân. Sau 30 phút bề dày của lớp kền là 0,03 mm. Biết nguyên tử lượng
N
i
58
, hóa trị 2, khối lượng riêng
D
8
,
9
.
10
3
k
g
/
m
3
. Dòng điện qua bình đ...
Đọc tiếp
Mạ kền (Niken) cho một bề mặt kim loại có diện tích 40 c m 2 bằng điện phân. Sau 30 phút bề dày của lớp kền là 0,03 mm. Biết nguyên tử lượng N i = 58 , hóa trị 2, khối lượng riêng D = 8 , 9 . 10 3 k g / m 3 . Dòng điện qua bình điện phân có cường độ là
A. 3A
B. 1,97A
C. 2,5A
D. 1,5A
Một bình điện phân đựng dung dịch
CuSO
4
với hai cực bằng đồng. Khi cho dòng điện không đổi chạy qua bình điện phân trong thời gian 30 phút thì thấy khối lượng catôt tăng thêm 1,143 g. Cho khối lượng nguyên tử đồng A 63,5. Cường độ dòng điện chạy qua bình là A. 1,93 A B. 0,96 mA C. 1,93 mA D. 0,96 A
Đọc tiếp
Một bình điện phân đựng dung dịch CuSO 4 với hai cực bằng đồng. Khi cho dòng điện không đổi chạy qua bình điện phân trong thời gian 30 phút thì thấy khối lượng catôt tăng thêm 1,143 g. Cho khối lượng nguyên tử đồng A = 63,5. Cường độ dòng điện chạy qua bình là
A. 1,93 A
B. 0,96 mA
C. 1,93 mA
D. 0,96 A
Để xác định đương lượng điện hóa của đồng một học sinh đã cho dòng điện có cường độ 1,2 A chạy qua bình điện phân chứa dung dịch đồng sunphat (CuSO4) trong khoảng thời gian 5 phút và thu được 120 mg đồng bám vào catot. Lấy số Faraday F 96500 C/mol, khối lượng mol nguyên tử của đồng là A 63,5 g/mol và hóa trị n 2 thì sai số tỉ đối của kết quả thí nghiệm do học sinh này thực hiện so với kết quả tính toán theo định luật II Faraday là A. 1,3 % B. 1,2 % C. 2,2 % D. 2,3 %
Đọc tiếp
Để xác định đương lượng điện hóa của đồng một học sinh đã cho dòng điện có cường độ 1,2 A chạy qua bình điện phân chứa dung dịch đồng sunphat (CuSO4) trong khoảng thời gian 5 phút và thu được 120 mg đồng bám vào catot. Lấy số Faraday F= 96500 C/mol, khối lượng mol nguyên tử của đồng là A = 63,5 g/mol và hóa trị n = 2 thì sai số tỉ đối của kết quả thí nghiệm do học sinh này thực hiện so với kết quả tính toán theo định luật II Faraday là
A. 1,3 %
B. 1,2 %
C. 2,2 %
D. 2,3 %
Một bình điện phân chứa dung dịch AgN
O
3
với anôt bằng bạc. Khối lượng bạc bám vào catôt của bình điện phân sau 16 phút 5 giây là 6,48 g. Biết bạc có khối lượng mol là A 108 g/mol và hóa trị n 1. Lấy số Fa – ra – đây F 96500 C/mol. Cường độ dòng điện chạy qua bình điện phân là A. 5 A. B. 6 A. C. 0,5 A. D. 4 A.
Đọc tiếp
Một bình điện phân chứa dung dịch AgN O 3 với anôt bằng bạc. Khối lượng bạc bám vào catôt của bình điện phân sau 16 phút 5 giây là 6,48 g. Biết bạc có khối lượng mol là A = 108 g/mol và hóa trị n = 1. Lấy số Fa – ra – đây F = 96500 C/mol. Cường độ dòng điện chạy qua bình điện phân là
A. 5 A.
B. 6 A.
C. 0,5 A.
D. 4 A.