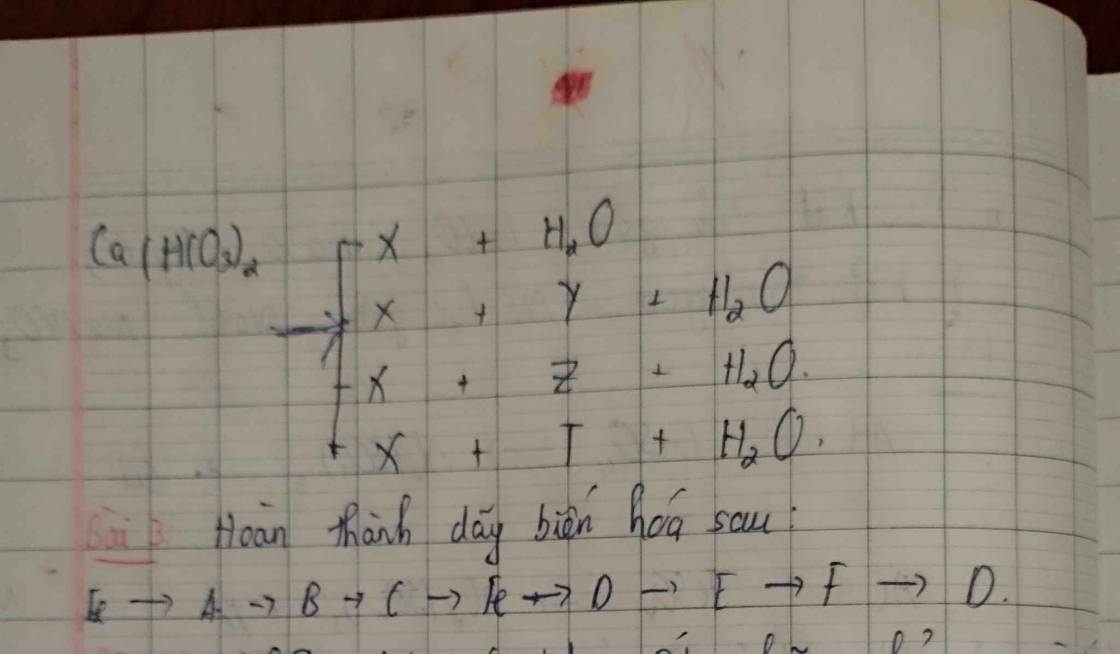1.
(1) CuSO4 + Fe ➜FeSO4+Cu
(2) 2NaOH +FeSO4 ➜Na2SO4+Fe(OH)2
(3)Fe(OH)2 +2HCl ➞ FeCl2 +2H2O
(4)FeCl2➞ Fe +Cl2
(5) 2Fe + 6H2SO4➞Fe2(SO4)3 +3SO2 +6H2O
(6) 3Fe2(SO4)3 + BaCl2➞2FeCl3 +3BaSO4
2.
a) 2Al +3CuSO4➞Al2(SO4)3 +3Cu
- Hiện tượng xảy ra :Có chất rắn màu nâu đỏ chính là đồng bám bên ngoài lá nhôm ,màu xanh của dd CuSO4 nhạt dần
b)Zn + CuCl2 ➞ ZnCl2 +Cu
- Đồng clorua đang ở màu xanh lam ➝nhạt màu ➝xuất hiện chất rắn (kết tủa màu đỏ bám vào thanh kẽm)
c)2Na + 2H2O ➞ 2NaOH +H2
2NaOH +CuSO4 ➞Cu(OH)2+Na2SO4
- có khí không màu thoát ra ,thu đc kết tủa xanh đậm.
3. Cho nước vào từng mẫu thử
+ Tan, có khí thoát ra : Na
+ Không tan : Còn lại Zn, ZnO , Ag
Cho dung dịch HCl vào các mẫu thử không tan
+ Tan, có khí thoát ra: Zn
Zn + 2HCl -------> ZnCl2 + H2
+ Tan : ZnO
ZnO + 2HCl -------> ZnCl2 + H2O
+ Không tan : Ag
4. \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Gọi V là thể tích cần tìm
Ta có : \(n_{H^+}=2V+V.1.2=4V\left(mol\right)\) (1)
\(Al+3H^+\rightarrow Al^{3+}+\dfrac{3}{2}H_2\)
Theo PT: \(n_{H^+}=3n_{Al}=0,9\left(mol\right)\) (2)
(1), (2) => V=0,225 (lít)
5. Fe + CuSO4 ----------> FeSO4 + Cu
Gọi x là số mol Fe phản ứng
Ta có : \(m_{tăng}=m_{Cu\left(sinhra\right)}-m_{Fe\left(pứ\right)}=64x-56x=10,4-10=0,4\left(mol\right)\)
=> x=0,05 (mol)
=> \(m_{Cu}=0,05.64=3,2\left(g\right)\)

 giải dùm em với ạ
giải dùm em với ạ




 Giải dùm em bài 1,2,3,4,5 với ạ
Giải dùm em bài 1,2,3,4,5 với ạ Giải dùm em ạ
Giải dùm em ạ
 giải dùm em voi
giải dùm em voi