Các câu hỏi tương tự
Điện phân dung dịch chứa a mol C u S O 4 và b mol NaCl với 2a < b (điện cực trơ). Cho vài giọt quì vào dung dịch, màu của dung dịch sẽ biến đổi thế nào trong quá trình điện phân:
A. Tím sang đỏ
B. Đỏ sang tím rồi xanh
C. Tím sang xanh
D. Không đổi màu
Điện phân dung dịch CuSO4 và H2SO4 với cả 2 điện cực đều bằng Cu. Thành phần dung dịch và khối lượng các điện cực thay đổi như thế nào trong quá trình điện phân? A. Nồng độ H2SO4 tăng dần và nồng độ CuSO4 giảm dần, khối lượng catot tăng, khối lượng anot không đổi. B. Nồng độ H2SO4 và nồng độ CuSO4 không đổi, khối lượng của 2 điện cực không đổi. C. Nồng độ H2SO4 và nồng độ CuSO4 không đổi, khối lượng catot tăng và khối lượng anot giảm. D. Nồng độ H2SO4, nồng độ CuSO4 giảm dần, khối lượng catot...
Đọc tiếp
Điện phân dung dịch CuSO4 và H2SO4 với cả 2 điện cực đều bằng Cu. Thành phần dung dịch và khối lượng các điện cực thay đổi như thế nào trong quá trình điện phân?
A. Nồng độ H2SO4 tăng dần và nồng độ CuSO4 giảm dần, khối lượng catot tăng, khối lượng anot không đổi.
B. Nồng độ H2SO4 và nồng độ CuSO4 không đổi, khối lượng của 2 điện cực không đổi.
C. Nồng độ H2SO4 và nồng độ CuSO4 không đổi, khối lượng catot tăng và khối lượng anot giảm.
D. Nồng độ H2SO4, nồng độ CuSO4 giảm dần, khối lượng catot tăng, khối lượng anot giảm.
Điện phân dung dịch X chứa m gam hỗn hợp Cu(NO3)2 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I 2,5A. Sau 9264 giây, thu được dung dịch Y (vẫn còn màu xanh) và hỗn hợp khí ở anot có tỉ khối so với H2 bằng 25,75. Mặt khác, nếu điện phân X trong thời gian t giây thì thu được tổng số mol khí ở hai điện cực là 0,11 mol (số mol khí thoát ra ở điện cực này gấp 10 lần số mol khí thoát ra ở điện cực kia). Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong n...
Đọc tiếp
Điện phân dung dịch X chứa m gam hỗn hợp Cu(NO3)2 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2,5A. Sau 9264 giây, thu được dung dịch Y (vẫn còn màu xanh) và hỗn hợp khí ở anot có tỉ khối so với H2 bằng 25,75. Mặt khác, nếu điện phân X trong thời gian t giây thì thu được tổng số mol khí ở hai điện cực là 0,11 mol (số mol khí thoát ra ở điện cực này gấp 10 lần số mol khí thoát ra ở điện cực kia). Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Tỉ lệ khối lượng của NaCl so với Cu(NO3)2 là
A. 39/110
B. 39/235
C. 177/94
D. 117/376
Trong quá trình điện phân dung dịch Pb(NO3)2 với các điện cực trơ, ion Pb2+ di chuyển về
A. catot và bị oxi hóa
B. anot và bị oxi hóa
C. catot và bị khử
D. anot và bị khử
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây? A. (2). B. (4). C. (1). D. (3).
Đọc tiếp
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a < 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây?

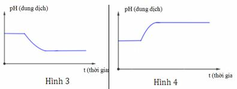
A. (2).
B. (4).
C. (1).
D. (3).
Điện phân dung dịch X gồm x mol KCl và y mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp), khi nước bắt đầu bị điện phân ở cả hai điện cực thì ngừng điện phân thu được dung dịch Y (làm quỳ tím hóa xanh), có khối lượng giảm 2,755 gam so với khối lượng dung dịch X ban đầu (giả thiết nước bay hơi không đáng kể). Trung hòa toàn bộ lượng Y bằng dung dịch HCl 1M thì cần 20 ml. Tỉ lệ x : y có giá trị gần nhất với A. 0,75 B. 1,25 C. 1,65 D. 3,35
Đọc tiếp
Điện phân dung dịch X gồm x mol KCl và y mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp), khi nước bắt đầu bị điện phân ở cả hai điện cực thì ngừng điện phân thu được dung dịch Y (làm quỳ tím hóa xanh), có khối lượng giảm 2,755 gam so với khối lượng dung dịch X ban đầu (giả thiết nước bay hơi không đáng kể). Trung hòa toàn bộ lượng Y bằng dung dịch HCl 1M thì cần 20 ml. Tỉ lệ x : y có giá trị gần nhất với
A. 0,75
B. 1,25
C. 1,65
D. 3,35
Điện phân 1 lit dung dịch có chứa 18,8 gam
Cu
NO
3
2
và 29,8 gam KCl bằng điện cực trơ, có màng ngăn xốp. Sau 1 thời gian thấy khối lượng dung dịch giảm 34,3 gam so với ban đầu. Coi thể tích dung dịch không đổi trong quá trình điện phân, Nồng độ các chất trong dung dịch sau khi điện phân là A. KCl 0,1M; KNO3 0,2M ; KOH 0,1M B.
KNO
3
0,1 M ; KCl 0,2...
Đọc tiếp
Điện phân 1 lit dung dịch có chứa 18,8 gam Cu NO 3 2 và 29,8 gam KCl bằng điện cực trơ, có màng ngăn xốp. Sau 1 thời gian thấy khối lượng dung dịch giảm 34,3 gam so với ban đầu. Coi thể tích dung dịch không đổi trong quá trình điện phân, Nồng độ các chất trong dung dịch sau khi điện phân là
A. KCl 0,1M; KNO3 0,2M ; KOH 0,1M
B. KNO 3 0,1 M ; KCl 0,2 M
C. KCl 0,05M ; KNO 3 0,2M ; KOH 0,15M
D. KNO 3 0,2M, KOH 0,2M
Điện phân 100 ml dung dịch Cu(NO3)2 2M với điện cực trơ trong t giây, cường độ dòng điện không đổi 1,93A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 16,8 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 15,99 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là A. 5000 B. 4820 C. 3610 D. 6000
Đọc tiếp
Điện phân 100 ml dung dịch Cu(NO3)2 2M với điện cực trơ trong t giây, cường độ dòng điện không đổi 1,93A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 16,8 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 15,99 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là
A. 5000
B. 4820
C. 3610
D. 6000
Điện phân dung dịch chứa Fe(NO3)3 ; Cu(NO3)2 với I 10A, điện cực trơ đến khi dung dịch vừa hết màu xanh thì dừng lại, khi đó ở anot thu được 0,196 lít khí (đktc) và khối lượng dung dịch giảm 0,92g. Thời gian điện phân, số mol từng muối trước điện phân theo thứ tự trên là: A. 6,5 phút; 0,01 mol; 0,02 mol B. 5,6 phút; 0,01 mol; 0,01 mol C. 6,5 phút; 0,01 mol; 0,015 mol D. 5,6 phút; 0,015 mol; 0,01 mol
Đọc tiếp
Điện phân dung dịch chứa Fe(NO3)3 ; Cu(NO3)2 với I = 10A, điện cực trơ đến khi dung dịch vừa hết màu xanh thì dừng lại, khi đó ở anot thu được 0,196 lít khí (đktc) và khối lượng dung dịch giảm 0,92g. Thời gian điện phân, số mol từng muối trước điện phân theo thứ tự trên là:
A. 6,5 phút; 0,01 mol; 0,02 mol
B. 5,6 phút; 0,01 mol; 0,01 mol
C. 6,5 phút; 0,01 mol; 0,015 mol
D. 5,6 phút; 0,015 mol; 0,01 mol




