Các câu hỏi tương tự
Hãy chọn nửa sơ đồ phản ứng ở cột II để ghép với nửa sơ đồ phản ứng II cột I cho phù hợp.
Cột I
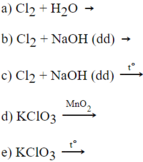
Cột II
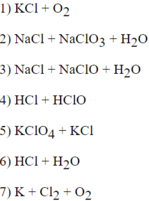
Câu 1. Phản ứng nào sau đây thuộc loại phản ứng oxi hóa – khử? Xác định chất oxi hóa và chất khử trong các phản ứng oxi hóa khử đó.(1) 2SO2 + O2 → 2SO3.(2) Fe2O3 + CO → 2FeO + CO2.(3) 2H2S + SO2 → 3S + 2H2O.(4) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.(5) 2H2O2 → 2H2O + O2.(6) 2KClO3 → 2KCl + 3O2.(7) P2O5 + 3H2O → 2H3PO4.(8) KOH + CO2 → KHCO3.(9) Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O.(10) 2Al + Fe2O3 → Al2O3 + 2Fe
Đọc tiếp
Câu 1. Phản ứng nào sau đây thuộc loại phản ứng oxi hóa – khử? Xác định chất oxi hóa và chất khử trong các phản ứng oxi hóa khử đó.
(1) 2SO2 + O2 → 2SO3.
(2) Fe2O3 + CO → 2FeO + CO2.
(3) 2H2S + SO2 → 3S + 2H2O.
(4) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
(5) 2H2O2 → 2H2O + O2.
(6) 2KClO3 → 2KCl + 3O2.
(7) P2O5 + 3H2O → 2H3PO4.
(8) KOH + CO2 → KHCO3.
(9) Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O.
(10) 2Al + Fe2O3 → Al2O3 + 2Fe
ĐỀ 17Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.1. Zn + HNO3 - Zn(NO3)2 + N2O + H2O2. Mg + H2SO4 - MgSO4 + H2S + H2O. Câu 2: Hợp chất khí với H của một nguyên tố ứng với công thức RH3. Oxit cao nhất của nó chứa 25,93%R. Gọi tên nguyên tố đó?Câu 3: Cho 22 gam hỗn hợp Fe và Al tác dụng vừa đủ với dung dịch HCl 3,7%. Sau phản ứng thu được 17,92 lít khí(đktc) a. Tính% khối lượng mỗi kim loại trong h...
Đọc tiếp
ĐỀ 17
Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.
1. Zn + HNO3 -> Zn(NO3)2 + N2O + H2O
2. Mg + H2SO4 -> MgSO4 + H2S + H2O.
Câu 2: Hợp chất khí với H của một nguyên tố ứng với công thức RH3. Oxit cao nhất của nó chứa 25,93%R. Gọi tên nguyên tố đó?
Câu 3: Cho 22 gam hỗn hợp Fe và Al tác dụng vừa đủ với dung dịch HCl 3,7%. Sau phản ứng thu được 17,92 lít khí(đktc) a. Tính% khối lượng mỗi kim loại trong hỗn hợp. b. Tính khối lượng dung dịch HCl đã dùng
Lưu huỳnh đioxit có thể tham gia những phản ứng sau: SO2 + Br2 + 2H2O → 2HBr + H2SO4 (1) SO2 + 2H2S → 3S + 2H2O (2) Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên? A. Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa. B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử. C. Phản ứng (2) : SO2 vừa là chất khử, vừa là chất oxi hóa. D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.
Đọc tiếp
Lưu huỳnh đioxit có thể tham gia những phản ứng sau:
SO2 + Br2 + 2H2O → 2HBr + H2SO4 (1)
SO2 + 2H2S → 3S + 2H2O (2)
Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên?
A. Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (2) : SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.
Xác định số oxi hóa, viết phương trình cho nhận e, cho biết chất khử, chất oxi hóa, quá trình khử, quá trình oxi hoá của các phản ứng sau:1/ Cu + H2SO4 ® CuSO4 + SO2 + H2O2/ MnO2 + HCl ® MnCl2 + Cl2 + H2O3/ Mg + HNO3 ® Mg(NO3)2 + N2 +H2O4/ FeO+ HNO3¦ Fe(NO3)3+ NO + H2O5/ Ag + HNO3 ® AgNO3 + NO2 + H2O6/ Fe + HNO3® Fe(NO3)3 + N2O+H2O7/ Al+H2SO4 (đặc) Al2 (SO4)3+ H2S + H2O8/ Al + Fe2O3 Al2O3 + Fe.
Đọc tiếp
Xác định số oxi hóa, viết phương trình cho nhận e, cho biết chất khử, chất oxi hóa, quá trình khử, quá trình oxi hoá của các phản ứng sau:
1/ Cu + H2SO4 ® CuSO4 + SO2 + H2O
2/ MnO2 + HCl ® MnCl2 + Cl2 + H2O
3/ Mg + HNO3 ® Mg(NO3)2 + N2 +H2O
4/ FeO+ HNO3¦ Fe(NO3)3+ NO + H2O
5/ Ag + HNO3 ® AgNO3 + NO2 + H2O
6/ Fe + HNO3® Fe(NO3)3 + N2O+H2O
7/ Al+H2SO4 (đặc) Al2 (SO4)3+ H2S + H2O
8/ Al + Fe2O3 Al2O3 + Fe.
Cho m gam Mg tác dụng vừa đủ với dung dịch H2SO4 loãng dư thu được 3,36 lít H2 (ở đktc) và dung dich X
a) Viết phương trình phản ứng xảy ra
b) Xác định chất oxi hóa, chất khử , quá trình cho nhận e
c) Tính m bằng 2 cách (Tính theo phương trình hóa học và định luật bảo toàn electron)
Cân bằng các phương trình phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
e) Cl2 +KOH → KCl + KClO3 + H2O
ĐỀ 18Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.1. Fe + HNO3 - Fe(NO3)3 + NO2 + H2O2. Mg + HNO3 -Mg(NO3)2 + NH4NO3 + H2O.Câu 2: Cho m gam muối natri clorua tác dụng vừa đủ với 25,5 gam bạc nitrat. Tính m.Câu 3: Hòa tan hoàn toàn 15,75g hỗn hợp Mg và Zn vào dung dịch HCl 10%. Sau phản ứng kết thúc đem cô cạn dung dịch thu được 44,15g muối clorua. Tính a. Phần trăm khối lượng mỗi kim loại trong hỗ...
Đọc tiếp
ĐỀ 18
Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.
1. Fe + HNO3 -> Fe(NO3)3 + NO2 + H2O
2. Mg + HNO3 ->Mg(NO3)2 + NH4NO3 + H2O.
Câu 2: Cho m gam muối natri clorua tác dụng vừa đủ với 25,5 gam bạc nitrat. Tính m.
Câu 3: Hòa tan hoàn toàn 15,75g hỗn hợp Mg và Zn vào dung dịch HCl 10%. Sau phản ứng kết thúc đem cô cạn dung dịch thu được 44,15g muối clorua. Tính a. Phần trăm khối lượng mỗi kim loại trong hỗn hợp. b. Khối lượng dung dịch HCl đã phản ứng
DỀ 16Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.1. Cu + HNO3 - Cu(NO3)2 + NO + H2O2. Fe + H2SO4 - Fe2(SO4)3 + SO2 + H2OCâu 2: Cho 6,72 lít khí clo phản ứng vừa đủ với m gam sắt, thu được muối clorua. Tính m.Câu 3: Hòa tan hoàn toàn 10,16g hỗn hợp (Fe và Mg) trong 500ml dung dịch HCl vừa đủ thì thu được 5,6 lít khí(đktc). a. Tính khối lượng mỗi kim loại trong hỗn hợp b. Tính nồng độ mol dung dịch...
Đọc tiếp
DỀ 16
Câu 1: Cân bằng các phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng.
1. Cu + HNO3 -> Cu(NO3)2 + NO + H2O
2. Fe + H2SO4 -> Fe2(SO4)3 + SO2 + H2O
Câu 2: Cho 6,72 lít khí clo phản ứng vừa đủ với m gam sắt, thu được muối clorua. Tính m.
Câu 3: Hòa tan hoàn toàn 10,16g hỗn hợp (Fe và Mg) trong 500ml dung dịch HCl vừa đủ thì thu được 5,6 lít khí(đktc). a. Tính khối lượng mỗi kim loại trong hỗn hợp b. Tính nồng độ mol dung dịch HCl dã dùng









