Câu 4 :
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,4 .36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{10}=146\left(g\right)\)
b) Số mol của muối sắt (II) clorua
nFeCl2= \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,2 . 127
= 25,4 (g)
Chúc bạn học tốt
Câu 3 :
200ml = 0,2l
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,2=0,2\left(mol\right)\)
a) Pt : Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,1 0,2 0,1 0,1
b) Số mol của kẽm
nZn = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Khối lượng của kẽm
mZn= nZn . MZn
= 0,1 . 65
= 6,5 (g)
Số mol của khí hidro
nH2= \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tich của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,1 . 22,4
= 2,24 (l)
c) Khối lượng củadung dịch axit clohidric
D = \(\dfrac{m}{V}\Rightarrow m=D.V=1,1.200=220\left(g\right)\)
Khối lượng của dung dịch sau phản ứng mdung dịch sau phản ứng = 6,5 + 220
= 226,5 (g)
Số mol của kẽm clorua
nZnCl2= \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của kẽm clorua
mZnCl2= nZnCl2 . MznCl2
= 0,1. 136
= 13,6 (g)
Nồng độ phần trăm của kẽm clorua
C0/0ZnCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{13,6.100}{226,5}=6\)0/0
Chúc bạn học tốt















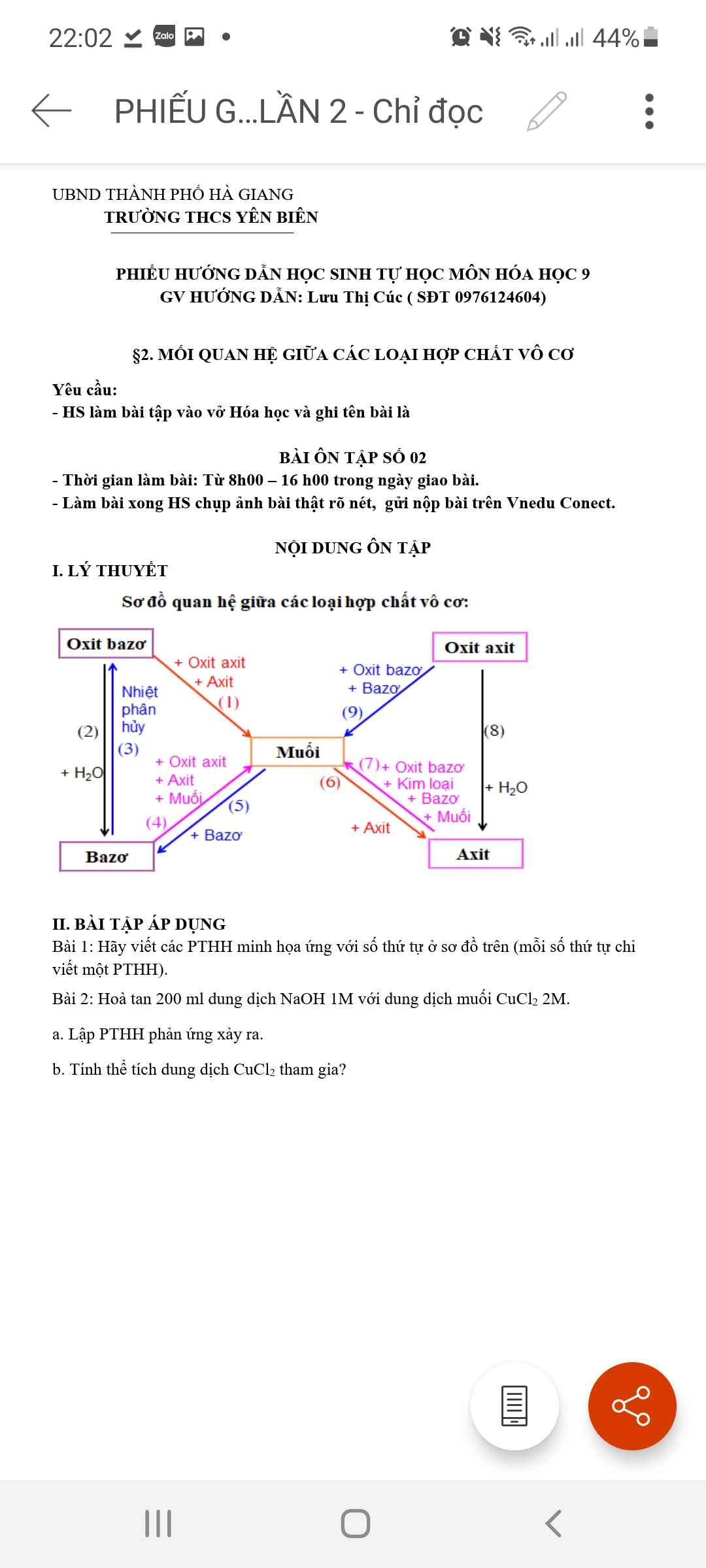

 mk cần câu b thôi nha
mk cần câu b thôi nha
