Các electron thuộc lớp K liên kết với hạt nhân chặt chẽ hơn lớp L vì gần hạt nhân hơn và mức năng lượng thấp hơn.
Đúng 0
Bình luận (0)
Các câu hỏi tương tự
Cho các phát biểu sau: 1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân 2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron 3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng 4. Phân lớp p chứa tối đa 6 electron 5. Các electron trên cùng một lớp có mức năng lượng bằng nhau 6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu Số phát biểu đúng là A. 4 B. ...
Đọc tiếp
Cho các phát biểu sau:
1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron
3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng
4. Phân lớp p chứa tối đa 6 electron
5. Các electron trên cùng một lớp có mức năng lượng bằng nhau
6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
Số phát biểu đúng là
A. 4
B. 3
C. 1
D. 2
Cho các phát biểu sau : 1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân 2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron 3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng 4. Phân lớp p chứa tối đa 6 electron 5. Các electrong trên cùng một lớp có mức năng lượng gần bằng nhau 6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái đấu Số phát biểu đúng là : A. 4...
Đọc tiếp
Cho các phát biểu sau :
1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron
3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng
4. Phân lớp p chứa tối đa 6 electron
5. Các electrong trên cùng một lớp có mức năng lượng gần bằng nhau
6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái đấu
Số phát biểu đúng là :
A. 4.
B. 3.
C. 1.
D. 2.
Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là: A. sự góp chung đôi electron B. sự góp đôi electron từ một nguyên tử C. sự tương tác yếu giữa hai nguyên tử có chênh lệch độ âm điện lớn D. lực hút tĩnh điện giữa hai ion trái dấu
Đọc tiếp
Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là:
A. sự góp chung đôi electron
B. sự góp đôi electron từ một nguyên tử
C. sự tương tác yếu giữa hai nguyên tử có chênh lệch độ âm điện lớn
D. lực hút tĩnh điện giữa hai ion trái dấu
Cho các phát biểu sau (1) HCl chứa liên kết ion trong phân tử (2) Trong nguyên tử, số khối bằng tổng các hạt proton và notron (3) Tất cả các nguyên tố trong nhóm IA đều là kim loại kiềm (4) Trong cùng một chu kì, các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân (5) Trong cúng một chu kì, các nguyên tố có lớp electron bằng nhau Số phát biểu đúng là A. 3 B. 5 C. 4 D. 2
Đọc tiếp
Cho các phát biểu sau
(1) HCl chứa liên kết ion trong phân tử
(2) Trong nguyên tử, số khối bằng tổng các hạt proton và notron
(3) Tất cả các nguyên tố trong nhóm IA đều là kim loại kiềm
(4) Trong cùng một chu kì, các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân
(5) Trong cúng một chu kì, các nguyên tố có lớp electron bằng nhau
Số phát biểu đúng là
A. 3
B. 5
C. 4
D. 2
Cho các hạt α bắn phá qua một lớp nguyên tử vàng (Au) dát mỏng (thí nghiệm mô phỏng như hình bên). Thì thấy cứ 108 hạt α sẽ có một hạt bị bật lại vì va chạm với hạt nhân nguyên tử vàng, các hạt α không va chạm với hạt nhân sẽ xuyên qua. Tỷ lệ bán kính nguyên tử và bán kính hạt nhân của nguyên tử vàng là k lần (giả thiết rằng hạt nhân và nguyên tử đều là hình cầu, khoảng trống giữa các nguyên tử là không đáng kể). Giá trị của k là: A. 108 B. 102 C. 103 D. 104
Đọc tiếp
Cho các hạt α bắn phá qua một lớp nguyên tử vàng (Au) dát mỏng (thí nghiệm mô phỏng như hình bên). Thì thấy cứ 108 hạt α sẽ có một hạt bị bật lại vì va chạm với hạt nhân nguyên tử vàng, các hạt α không va chạm với hạt nhân sẽ xuyên qua. Tỷ lệ bán kính nguyên tử và bán kính hạt nhân của nguyên tử vàng là k lần (giả thiết rằng hạt nhân và nguyên tử đều là hình cầu, khoảng trống giữa các nguyên tử là không đáng kể).
Giá trị của k là:
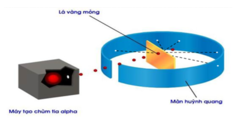
A. 108
B. 102
C. 103
D. 104
Ở trạng thái cơ bản: - Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1. - Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7. - Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt. Nhận xét nào sau đây là sai? ( biết Z 7 là F; Z 17 là Cl; Z - 11 là Na; Z 12 là Mg; Z 13 là Al; Z 19 là K) A. Số oxi hóa cao nhất của X trong hợp chất là +7 B. Oxit và hiđroxit của Y có tính lưỡng tính C. Độ âm đi...
Đọc tiếp
Ở trạng thái cơ bản:
- Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1.
- Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7.
- Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt. Nhận xét nào sau đây là sai? ( biết Z = 7 là F; Z = 17 là Cl; Z - 11 là Na; Z = 12 là Mg; Z = 13 là Al; Z = 19 là K)
A. Số oxi hóa cao nhất của X trong hợp chất là +7
B. Oxit và hiđroxit của Y có tính lưỡng tính
C. Độ âm điện giảm dần theo thứ tự X, Y, Z
D. Nguyên tố X và Y thuộc 2 chu kì kế tiếp
R là nguyên tố mà nguyên tử có phân lớp electron ngoài cùng là np2n+1 (n là số thứ tự của lớp electron). Có các nhận xét sau về R ? (I) Tổng số hạt mang điện của nguyên tử R là 18. (II) Số electron ở lớp ngoài cùng trong nguyên tử R là 7. (III) Hóa trị cao nhất của R trong oxit là 7 (IV) Dung dịch NaR tác dụng với dung dịch AgNO3 tạo kết tủaSố phát biểu đúng là: A . 4 B. 2 C . 1 D. 3
Đọc tiếp
R là nguyên tố mà nguyên tử có phân lớp electron ngoài cùng là np2n+1 (n là số thứ tự của lớp electron). Có các nhận xét sau về R ?
(I) Tổng số hạt mang điện của nguyên tử R là 18.
(II) Số electron ở lớp ngoài cùng trong nguyên tử R là 7.
(III) Hóa trị cao nhất của R trong oxit là 7
(IV) Dung dịch NaR tác dụng với dung dịch AgNO3 tạo kết tủa
Số phát biểu đúng là:
A . 4
B. 2
C . 1
D. 3
Nguyên tử nguyên tố X có 5 elctron nằm trong các phân lớp s, nguyên tử nguyên tố Y có 11 electron nằm trong các phân lớp p. Hợp chất M tạo bởi X và Y. M chưa liên kết A.Cộng hóa trị phân cực B. Cộng hóa trị không phân cực C. Cho nhận D.ion
Đọc tiếp
Nguyên tử nguyên tố X có 5 elctron nằm trong các phân lớp s, nguyên tử nguyên tố Y có 11 electron nằm trong các phân lớp p. Hợp chất M tạo bởi X và Y. M chưa liên kết
A.Cộng hóa trị phân cực
B. Cộng hóa trị không phân cực
C. Cho nhận
D.ion
Trong chu kỳ 3, bảng HTTH các nguyên tố hóa học, khi điện tích hạt nhân tăng dần thì số electron lớp ngoài cùng trong nguyên tử các nguyên tố biến đổi thế nào?
A. Giảm dần
B. Tăng rồi giảm
C. Không đổi
D. Tăng dần



