Bài 1 :
1) \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
2) \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+SO_2+H_2O\)
3) \(K_2SO_3+2HCl\rightarrow2KCl+SO_2+H_2O\)
Chúc bạn học tốt
Bài 1 :
1) \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
2) \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+SO_2+H_2O\)
3) \(K_2SO_3+2HCl\rightarrow2KCl+SO_2+H_2O\)
Chúc bạn học tốt
Bài 1. (3đ) Hoàn thành các phương trình hóa học sau:
1/ Al2O3 + H2SO4 → ? + ?
…………………………………………………………………………………………...
2/ ? + ? → Na2SO4 + ? + H2O
…………………………………………………………………………………………....
3/ K2SO3 + HCl →
………………………………………………………………………………………………
Hoàn thành các phương trình hóa học sau: 1. H2SO4 + NaOH 2. HCl + Al2O3 3. Fe+H2SO4 4. Cu(OH)2 5. NaOH+P2O5 6. Fe(OH)3+H2SO4
Bài 2: Hoàn thành các phương trình phản ứng sau:
1. ? + CuO → CuCl2 + ?
2. H2SO4 + K2SO3 → K2SO4 + ? + ?
3. P2O5 + H2O → ?
4. Al(OH)3 + H2SO4 → ? + ?
5. Fe(OH)3 + ? → Fe2(SO4)3 + ?
6. ? + ? → H2SO4
7. Na2SO3 + ? → Na2SO4 + ? + ?
8. HCl + ZnO → ? + ?
9. CO2 + Ca(OH)2 → ? + ?
10. Fe2O3 + ? → FeCl2 + H2O
11. Na2O + H2O →
chỉ em với mn ,em cần gấp;-;
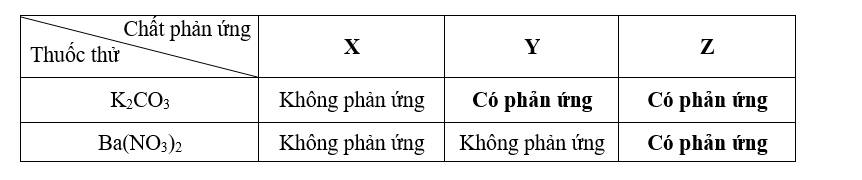 a. Xác định công thức hóa học của chất X, Y và Z.b. Nêu hiện tượng và viết phương trình hóa học của thí nghiệm có phản ứng xảy ra.Câu 4: (2,0 điểm) 4.1) Hòa tan hoàn toàn 6,5 gam kẽm bằng dung dịch H2SO4 loãng 19,6% vừa đủ.a. Viết phương trình hóa học.b. Tính thể tích khí hidro sinh ra (đktc).c. Cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hoà tan với kẽm. 4.2) Hòa tan 0,95 gam muối clorua của kim loại hóa trị II vào dung dịch AgNO3 dư thu được 2,87 gam chất kết tủa. Xác định công thức phân tử muối clorua.Câu 5: (2,0 điểm) Hòa tan hoàn toàn 14,2 gam gồm hỗn hợp bột CuO và Al2O3 cần 200ml dung dịch HCl 3,5M.a. Viết các phương trình hóa học. b. Tính thành phần phần trăm về khối lượng mỗi oxit trong hỗn hợp ban đầu ? Cho Zn = 65 ; Cl = 35,5 ; O = 16 ; H = 1; Al = 27 ; S = 32; Cu = 64 ; Mg = 24 ; Ag = 108 ; N = 14
a. Xác định công thức hóa học của chất X, Y và Z.b. Nêu hiện tượng và viết phương trình hóa học của thí nghiệm có phản ứng xảy ra.Câu 4: (2,0 điểm) 4.1) Hòa tan hoàn toàn 6,5 gam kẽm bằng dung dịch H2SO4 loãng 19,6% vừa đủ.a. Viết phương trình hóa học.b. Tính thể tích khí hidro sinh ra (đktc).c. Cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hoà tan với kẽm. 4.2) Hòa tan 0,95 gam muối clorua của kim loại hóa trị II vào dung dịch AgNO3 dư thu được 2,87 gam chất kết tủa. Xác định công thức phân tử muối clorua.Câu 5: (2,0 điểm) Hòa tan hoàn toàn 14,2 gam gồm hỗn hợp bột CuO và Al2O3 cần 200ml dung dịch HCl 3,5M.a. Viết các phương trình hóa học. b. Tính thành phần phần trăm về khối lượng mỗi oxit trong hỗn hợp ban đầu ? Cho Zn = 65 ; Cl = 35,5 ; O = 16 ; H = 1; Al = 27 ; S = 32; Cu = 64 ; Mg = 24 ; Ag = 108 ; N = 14Bài 1: Hoàn thành các phương trình phản ứng hóa học sau:
HCl + Fe
HCl + CuO
HCl + Mg(OH)2
HCl + Na2CO3
H2SO4 + Mg
H2SO4 + BaO
H2SO4 + NaOH
H2SO4 + BaSO3
Bài 2: Hòa tan hoàn toàn 11.2g Iron vào dung dịch sulfuric acid 1M vừa đủ phản ứng thu được khí A (đktc) và dung dịch B. ( Biết phản ứng xảy ra hoàn toàn)
Tính thể tích dung dịch sulfuric acid cần dùng.
Tính thể tích khí A
Tính nồng độ mol của chất có trong dung dịch B
Bài 3: Bằng phương pháp hóa học nhận biết 2 dung dịch không màu sau: HCl; H2SO4
Hoàn thành các phản ứng hóa học sau
1/ CaO + H2SO4 -). .. +.. .
2/ ... +... -) H2SO3
3/ CaO + H2O -)...
4/ ...+ NaOH -) Na2SO3+....
5/ K2SO3+ ... -) KCl+ ... + H2O
Hoàn thành các phương trình hóa học của các phản ứng sau:
(1) ….Mg + ….O2 ………………………
(2) …..Na2O + …H2O → ……………………….
(3) ….Fe + ….HCl → ………………………..…
(4) ….P + ….O2 …………………………
(5) ….Fe3O4 + ….CO ……………..…..
(6) ….Fe3O4 + ….HCl → ……………...…….….
(7) ….NaOH + ….H2SO4 →………………….…
(8) ….Fe(OH)2 + ….O2 + ….H2O → ….Fe(OH)3
(9) ….Al + ….HNO3 → ….Al(NO3)3 + ….NO + ….H2O
(10) ….K2Cr2O7 + ….HCl →….KCl + ….CrCl3 + ….Cl2 + ….H2O
2,Hoàn thành các PTPƯ sau và viết biểu thức định luật bảo toàn khối lượng cho mỗi phương trình sau:
(1) Al + O2 (5) KClO3
(2) Fe + Cl2 (6) Fe3O4 + CO
(3) CuO + HCl → (7) Cu + H2SO4 đ
(4) CO2 + NaOH → (8) Fe3O4 + HCl →
Hoàn thành các phương trình hóa học sau và cho biết phản ứng nào là phản ứng trao đổi: NaOH + HCl ( ? + H2O K2SO4 + Ba(NO3)2 ( KNO3 + ? CaO + ? ( Ca(OH)2 Ca(OH)2 + H2SO4 ( ? + H2O K2SO4 + BaCl2 ( KCl + ? FeSO4 + BaCl2 ( FeCl2 + ? SO3 + H2O ( ?
Nêu phương pháp hóa học nhận biết các dung dịch sau: a).Ca(OH)2 , H2SO4 , CaSO4 b). NaOH , H2O , HCl , Na2SO4