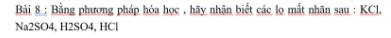7
\(n_{CO_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\\ n_{NaOH}=\dfrac{2}{40}=0,05\left(mol\right)\)
a
Các phản ứng có thể xảy ra:
\(CO_2+NaOH\rightarrow NaHCO_3\\CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
b
Thấy: \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,05}{0,07}=0,71< 1\Rightarrow\) phản ứng xảy ra theo tỉ lệ 1:1
\(CO_2+NaOH\rightarrow NaHCO_3\)
0,05---->0,05
b
\(m_{NaHCO_3}=0,05.84=4,2\left(g\right)\)
8
Lấy mỗi chất ra một ít và làm thí nghiệm sau:
- Nhúng quỳ tím vào các mẫu thử:
+ quỳ chuyển đỏ: `H_2SO_4`, `HCl` (I)
+ quỳ không chuyển màu: `KCl`, `Na_2SO_4` (II)
- Cho `BaCl_2` tác dụng với các chất vừa nhận biết ở nhóm (I):
+ có hiện tượng kết tủa trắng: `H_2SO_4`
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
+ không hiện tượng gì: `HCl`
- Tiếp tục cho `BaCl_2` tác dụng với các chất vừa nhận biết ở nhóm (II):
+ có hiện tượng kết tủa trắng: `Na_2SO_4`
\(BaCl_2+Na_2SO_4\rightarrow BaSO_4\downarrow+2NaCl\)
+ không hiện tượng gì: `KCl`
\(7\\ a.n_{CO_2}=\dfrac{1,568}{22,4}=0,07mol\\ n_{NaOH}=\dfrac{2}{40}=0,05mol\\ T=\dfrac{0,05}{0,07}=\dfrac{5}{7}>1\\ \Rightarrow Tạo.muối.axit\\ CO_2+NaOH\xrightarrow[]{}NaHCO_3\\ b.m_{NaHCO_3}=0,07.44+2=5,08g\)
8.
Trích mẫu thử
| \(KCl\) | \(Na_2SO_4\) | \(HCl\) | \(H_2SO_4\) | |
| Quỳ tím | _ | _ | đỏ | đỏ |
| \(AgNO_3\) | ↓Trắng | _ | ↓Trắng | _ |
| \(BaCl_2\) | _ | ↓Trắng | _ | ↓Trắng |
\(AgNO_3+KCl\xrightarrow[]{}AgCl\downarrow+KNO_3\\ AgNO_3+HCl\xrightarrow[]{}AgCl\downarrow+HNO_3\\ BaCl_2+H_2SO_4\xrightarrow[]{}BaSO_4\downarrow+HCl\\ BaCl_2+Na_2SO_4\xrightarrow[]{}BaSO_4\downarrow+2NaCl\)