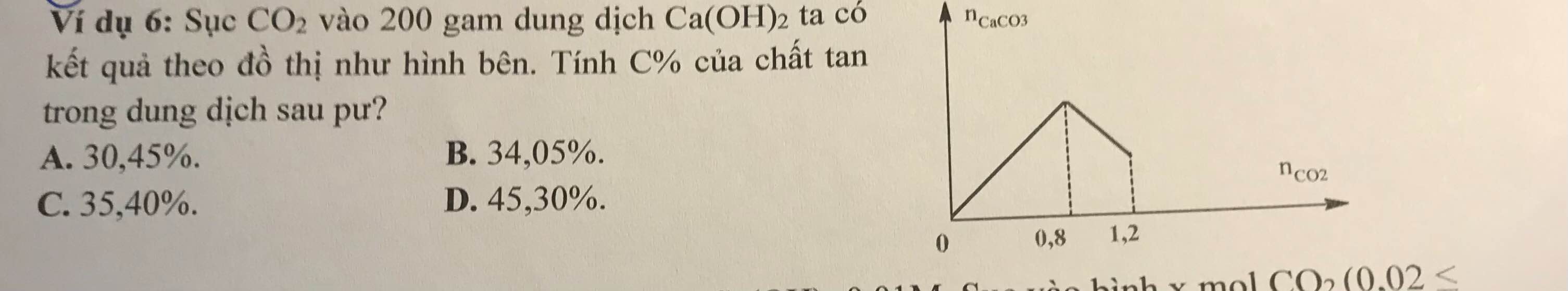$Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O$
$n_{Ca(OH)_2} = n_{CaCO_3\ max} = 0,8(mol)$
Khi $n_{CO_2} = 1,2(mol)$
$n_{CO_2} = 2n_{Ca(HCO_3)_2} + n_{CaCO_3} = 1,2(mol)$
$n_{Ca(OH)_2} = n_{Ca(HCO_3)_2} + n_{CaCO_3} = 0,8(mol)$
Suy ra: $n_{Ca(HCO_3)_2} = 0,4(mol) ; n_{CaCO_3} = 0,4(mol)$
Sau phản ứng, $m_{dd} = m_{CO_2} + m_{dd\ Ca(OH)_2} -m_{CaCO_3} = 1,2.44 + 200 -0,4.100= 212,8(gam)$
$C\%_{Ca(HCO_3)_2} = \dfrac{0,4.162}{212,8}.100\% = 30,45\%$
Đáp án A