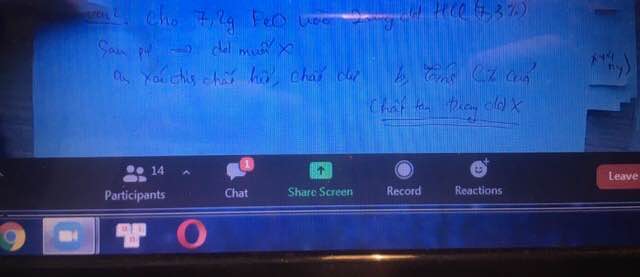
Số mol của sắt (II) oxit
nFeO = \(\dfrac{m_{FeO}}{M_{FeO}}=\dfrac{7,2}{72}=0,1\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.200}{100}=14,6\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
Pt : FeO + 2HCl → FeCl2 + H2O\(|\)
1 2 1 1
0,1 0,4 0,1
a) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\)
⇒ FeO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol FeO
b) Số mol của sắt (II) clorua
nFeCl2= \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,1 . 127
= 12,7 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFeO + mHCl
= 7,2 + 200
= 207,2 (g)
Nồng độ phần trăm của sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{12,7.100}{207,2}=6,13\)0/0
Chúc bạn học tốt