Đáp án B
Cân bằng phương trình phản ứng:
Cu + 2H2SO4 đặc to→ CuSO4 + SO2 + 2H2O
Đáp án B
Cân bằng phương trình phản ứng:
Cu + 2H2SO4 đặc to→ CuSO4 + SO2 + 2H2O
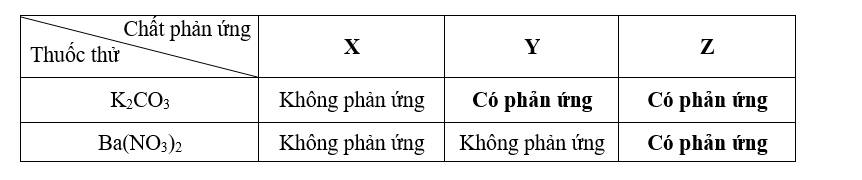 a. Xác định công thức hóa học của chất X, Y và Z.b. Nêu hiện tượng và viết phương trình hóa học của thí nghiệm có phản ứng xảy ra.Câu 4: (2,0 điểm) 4.1) Hòa tan hoàn toàn 6,5 gam kẽm bằng dung dịch H2SO4 loãng 19,6% vừa đủ.a. Viết phương trình hóa học.b. Tính thể tích khí hidro sinh ra (đktc).c. Cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hoà tan với kẽm. 4.2) Hòa tan 0,95 gam muối clorua của kim loại hóa trị II vào dung dịch AgNO3 dư thu được 2,87 gam chất kết tủa. Xác định công thức phân tử muối clorua.Câu 5: (2,0 điểm) Hòa tan hoàn toàn 14,2 gam gồm hỗn hợp bột CuO và Al2O3 cần 200ml dung dịch HCl 3,5M.a. Viết các phương trình hóa học. b. Tính thành phần phần trăm về khối lượng mỗi oxit trong hỗn hợp ban đầu ? Cho Zn = 65 ; Cl = 35,5 ; O = 16 ; H = 1; Al = 27 ; S = 32; Cu = 64 ; Mg = 24 ; Ag = 108 ; N = 14
a. Xác định công thức hóa học của chất X, Y và Z.b. Nêu hiện tượng và viết phương trình hóa học của thí nghiệm có phản ứng xảy ra.Câu 4: (2,0 điểm) 4.1) Hòa tan hoàn toàn 6,5 gam kẽm bằng dung dịch H2SO4 loãng 19,6% vừa đủ.a. Viết phương trình hóa học.b. Tính thể tích khí hidro sinh ra (đktc).c. Cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hoà tan với kẽm. 4.2) Hòa tan 0,95 gam muối clorua của kim loại hóa trị II vào dung dịch AgNO3 dư thu được 2,87 gam chất kết tủa. Xác định công thức phân tử muối clorua.Câu 5: (2,0 điểm) Hòa tan hoàn toàn 14,2 gam gồm hỗn hợp bột CuO và Al2O3 cần 200ml dung dịch HCl 3,5M.a. Viết các phương trình hóa học. b. Tính thành phần phần trăm về khối lượng mỗi oxit trong hỗn hợp ban đầu ? Cho Zn = 65 ; Cl = 35,5 ; O = 16 ; H = 1; Al = 27 ; S = 32; Cu = 64 ; Mg = 24 ; Ag = 108 ; N = 141.Cho từ từ V lít dung dịch HCl 1M vào 13,8g K2CO3 đến khi ngừng thoát khi. Giá trị của V là? ( K=39 C=12 O=16 )
2.Cho ptrinh hóa học sau: (?) H2SO4( đặc nóng ) + (?) Cu --> CuSO4 + SO2 + H2O. Hệ số thích hợp để đặt vào "(?)" là gì?
3.Kim loại X tác dụng với HCl giải phóng khí hidro. Dẫn toàn bộ lượng hidro trên qua ống nghiệm chứa oxit, nung nóng thu được kim loại X, Y. Vậy hai chất X, Y lần lượt là gì?
Câu 1. Cho các chất sau: Na2O, SO2, CuO, P2O5. Chất nào tác dụng với a/ H2O b/ dung dịch NaOH c/ dung dịch HCl Viết phương trình phản ứng xảy ra và cân bằng. Câu 2. Hoàn thành phương trình phản ứng sau và cân bằng. FeO + H2SO4 MgO + HCl ZnO + H2SO4 Na2O + HCl P2O5 + H2O CO2 + Ca(OH)2 Fe + HCl Fe + H2SO4 AlOH)3 + HCl CuO + H2SO4 Câu 3. Hòa tan m gam Mg bằng V lít dung dịch axit sunfuaric 1M. Sau phản ứng người ta thu được 4,48 lít khí H2 ở đktc a/ Tính giá trị m ? b/ Tính giá trị V ? c/ Tính khối lượng muối thu được sau phản ứng ?
c. ....BaCl2..... + AgNO3 → AgCl + ..NaNO3...........
Câu 2: Viết các phương trình hóa học cho mỗi chuyển hóa sau .
a. S ------->SO2 -------> SO3 -------> H2SO4 -------> BaSO4
b. CuSO4 ------->Cu(OH)2 -------> CuO -------> CuCl2 -------> NaCl
c. K2O -------> KOH -------> K2SO4 -------> KCl -------> KNO3
Cân Bằng Những PTHH sau:
a) FexOy + H2 → Fe + H2O
b) FexOy + HCl → FeCl2y/x + H2O
c) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O
d) M + H2SO4 → M2(SO4)n + SO2 + H2O
e) M + HNO3 → M(NO3)n + NO + H2O
f) FexOy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
Câu 2: Viết các phương trình hóa học cho mỗi chuyển hóa sau .
a. S ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4![]() BaSO4
BaSO4
b. CuSO4 ![]() Cu(OH)2
Cu(OH)2 ![]() CuO
CuO ![]() CuCl2
CuCl2 ![]() NaCl
NaCl
c. K2O ![]() KOH
KOH ![]() K2SO4
K2SO4 ![]() KCl
KCl ![]() KNO3
KNO3
Cân bằng PTHH sau:
M g + H 2 S O 2 đ , n → M g S O 4 + S O 2 + H 2 O
Hỏi tổng hệ số các chất phản ứng là bao nhiêu?
A. 2
B. 3
C. 4
D. 5
Câu 1: Hoàn thành các phương trình hoá học sau đây a.P2O5+H2O -> bHCl+Fe -> c.CuCl2+NaOH-> D.Na2CO4+H2SO4-> E.CuSO4+Zn-> Câu 2: thực hiện chuỗi phản ứng sau Cu->SO2->SO3->H2SO4->CuSO4->BaSO4
Câu 8: Cho các chất sau : CuSO4 ; SO3 ; Fe ; BaCl2 ; Cu ; Na2O. Viết phương trình phản ứng của chất: a. Tác dụng được với H2O tạo ra dung dịch làm quỳ tím hóa đỏ. b. Tác dụng được với dung dịch H2SO4 loãng sinh ra chất kết tủa trắng không tan trong nước và axit. c. Tác dụng được với dung dịch NaOH sinh ra chất kết tủa màu xanh lơ. d. Tác dụng với dung dịch HCL sinh ra chất khí nhẹ hơn không khí và cháy được trong không khí.