Các câu hỏi tương tự
Cho biết thứ tự từ trái sang phải của các cặp oxi hóa – khử trong dãy điện hóa (dãy thế điện cực chuẩn) như sau: Zn2+/Zn; Fe2+/Fe; Cu2+/ Cu; Fe3+/Fe2+; Ag+/Ag. Các kim loại và ion đều phản ứng được với ion Fe2+ trong dung dịch là A. Ag, Fe3+ B. Zn, Ag+. C. Ag, Cu2+ D. Zn, Cu2+
Đọc tiếp
Cho biết thứ tự từ trái sang phải của các cặp oxi hóa – khử trong dãy điện hóa (dãy thế điện cực chuẩn) như sau: Zn2+/Zn; Fe2+/Fe; Cu2+/ Cu; Fe3+/Fe2+; Ag+/Ag. Các kim loại và ion đều phản ứng được với ion Fe2+ trong dung dịch là
A. Ag, Fe3+
B. Zn, Ag+.
C. Ag, Cu2+
D. Zn, Cu2+
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử
M
g
2
+
/
M
g
;
Z
n
2
+
/
Z
n
;
C
u
2
+
/
C
u
;
A
g
+
/
A
g
;
H...
Đọc tiếp
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử M g 2 + / M g ; Z n 2 + / Z n ; C u 2 + / C u ; A g + / A g ; H g 2 + / H g lần lượt là –2,37 V; –0,76 V ; 0,34 V ; 0,8 V và 0,85 V. E 0 ( p i n ) = 3,22 V là suất điện động chuẩn của pin nào trong số các pin sau ?
A. Zn – Ag
B. Mg – Zn
C. Zn – Hg
D. Mg – Hg
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử
M
g
2
+
/
M
g
;
Z
n
2
+
/
Z
n
;
C
u
2
+
/
C
u
;
A
g...
Đọc tiếp
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử M g 2 + / M g ; Z n 2 + / Z n ; C u 2 + / C u ; A g + / A g ; H g 2 + / H g lần lượt là –2,37 V; –0,76 V ; 0,34 V ; 0,8 V ; và 0,85 V. E 0 ( p i n ) = 1,56 V là suất điện động chuẩn của pin nào trong số các pin sau
A. Zn – Ag
B. Mg – Zn
C. Zn – Hg
C. Zn – Hg
Điện phân a mol
Al
2
O
3
nóng chảy với điện cực bằng than chì. Hiệu suất điện phân là h%. Sau điện phân, tại anot thoát ra V lit khí (đktc) gồm khí
CO
2
và CO, trong đó phần trăm
CO
2
là b% về thế tích. Biểu thức liên hệ giữa a b, V và h là A.
V
22
,...
Đọc tiếp
Điện phân a mol Al 2 O 3 nóng chảy với điện cực bằng than chì. Hiệu suất điện phân là h%. Sau điện phân, tại anot thoát ra V lit khí (đktc) gồm khí CO 2 và CO, trong đó phần trăm CO 2 là b% về thế tích. Biểu thức liên hệ giữa a b, V và h là
A. V 22 , 4 100 + b = 3 ah
B. V 22 , 4 100 - b = 3 ah
C. V 22 , 4 100 + b = ah
D. V 22 , 4 100 - b = ah
Điện phân 400 ml (không đổi) dung dịch gồm NaCl, HCl và
C
u
C
l
2
0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng 1,93A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn dưới đâyGiá trị của t trên đồ thị là A. 3600 B. 3000 C. 1800 D. 1200
Đọc tiếp
Điện phân 400 ml (không đổi) dung dịch gồm NaCl, HCl và C u C l 2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng 1,93A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn dưới đây
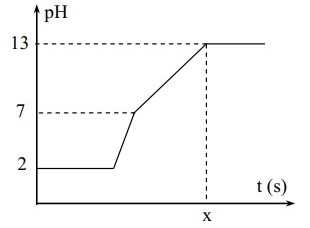
Giá trị của t trên đồ thị là
A. 3600
B. 3000
C. 1800
D. 1200
Cho thế điện cực của các cặp oxi hóa khử:
E
o
Z
n
2
+
/
Z
n
-
0
,
76
V
;
E
o
F
e
2
+...
Đọc tiếp
Cho thế điện cực của các cặp oxi hóa khử: E o Z n 2 + / Z n = - 0 , 76 V ; E o F e 2 + / F e = - 0 , 44 V ; E o P b 2 + / P b = - 0 , 13 V ; E o A g + / A g = 0 , 8 V . Pin điện hóa nào sau đây có suất điện động tiêu chuẩn bé nhất ?
A. Zn – Fe
B. Zn – Pb
C. Pb – Ag
D. Fe – Ag
Cho thế điện cực của các cặp oxi hóa khử:
E
o
Z
n
2
+
/
Z
n
-
0
,
76
V
;
E
o
F
e
2
+
/
F...
Đọc tiếp
Cho thế điện cực của các cặp oxi hóa khử: E o Z n 2 + / Z n = - 0 , 76 V ; E o F e 2 + / F e = - 0 , 44 V ; E o P b 2 + / P b = - 0 , 13 V ; E o A g + / A g = 0 , 8 V . Pin điện hóa nào sau đây có suất điện động tiêu chuẩn lớn nhất?
A. Zn – Fe
B. Zn – Pb
C. Pb – Ag
D. Fe – Ag
Điện phân 800 ml dung dịch gồm NaCl, HCl và
C
u
C
l
2
0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):Giá trị của t trên đồ thị là A. 2400 B. 3600 C. 1200 D. 3800
Đọc tiếp
Điện phân 800 ml dung dịch gồm NaCl, HCl và C u C l 2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):
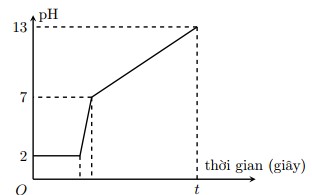
Giá trị của t trên đồ thị là
A. 2400
B. 3600
C. 1200
D. 3800
Điện phân 200ml dung dịch gồm NaCl, HCl và CuSO4 0,04M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 1,93A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị bên. Giả thiết thể tích dung dịch không đổi trong suốt quá trình điện phân. Giá trị của t (giây) trên đồ thị là: A. 1200 B. 3600. C. 1900 D. 3000.
Đọc tiếp
Điện phân 200ml dung dịch gồm NaCl, HCl và CuSO4 0,04M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 1,93A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị bên. Giả thiết thể tích dung dịch không đổi trong suốt quá trình điện phân.
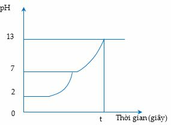
Giá trị của t (giây) trên đồ thị là:
A. 1200
B. 3600.
C. 1900
D. 3000.
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện ly nóng chảy hoặc dung dịch chất điện ly nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân: * Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. * Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. Cho dãy điệ...
Đọc tiếp
Sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện ly nóng chảy hoặc dung dịch chất điện ly nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân: * Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. * Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. Cho dãy điện hóa sau:
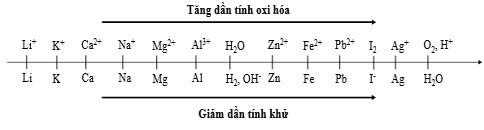
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời thời P b N O 3 2 và M g N O 3 2 bằng hệ điện phân sử dụng các điện cực than chì.
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm hãy cho biết Giá trị pH của dung dịch thay đổi như thế nào?
A. pH tăng do OH- sinh ra ở catot
B. pH giảm do H+ sinh ra ở anot
C. pH không đổi do không có H+ và OH- sinh ra
D. pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot


