Các câu hỏi tương tự
Muối
Fe
2
+
làm mất màu dung dịch
KMnO
4
trong môi trường axit tạo ra ion
Fe
3
+
, còn
Fe
3
+
tác dụng với
I
-
tạo ra
I
2
và...
Đọc tiếp
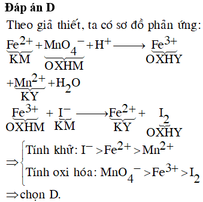
Muối Fe 2 + làm mất màu dung dịch KMnO 4 trong môi trường axit tạo ra ion Fe 3 + , còn Fe 3 + tác dụng với I - tạo ra I 2 và Fe 2 + . Sắp xếp các chất và ion Fe 3 + , I 2 và MnO 4 - theo thứ tự tăng dần tính oxi hóa:
A. I 2 < MnO 4 - < Fe 3 +
B. MnO 4 - < Fe 3 + < I 2
C. Fe 3 + < I 2 < MnO 4 -
D. I 2 < Fe 3 + < MnO 4 -
Để xác định nồng độ của cation Fe2+ trong dung dịch đã được axit hoá người ta chuẩn độ bằng dung dịch KMnO4 hoặc dung dịch K2Cr2O7 theo các ớ đồ phản ứng sau: Fe2+ + MnO4- + H+ ® Mn2+ + Fe3+ + H2O Fe2+ + Cr2O72- + H+ ® Cr3+ + Fe3+ + H2O Để chuẩn độ một dung dịch Fe2+ đã axit hoá cần phải dùng 30ml dung dịch KMnO4 0,02M. Để chuẩn độ cùng lượng dung dịch Fe2+ trên bằng dung dịch K2Cr2O7 thì thể tích dung dịch K2Cr2O7 0,02M cần dùng là: A. 10 ml B. 15 ml C. 20 ml D. 25 ml
Đọc tiếp
Để xác định nồng độ của cation Fe2+ trong dung dịch đã được axit hoá người ta chuẩn độ bằng dung dịch KMnO4 hoặc dung dịch K2Cr2O7 theo các ớ đồ phản ứng sau:
Fe2+ + MnO4- + H+ ® Mn2+ + Fe3+ + H2O
Fe2+ + Cr2O72- + H+ ® Cr3+ + Fe3+ + H2O
Để chuẩn độ một dung dịch Fe2+ đã axit hoá cần phải dùng 30ml dung dịch KMnO4 0,02M. Để chuẩn độ cùng lượng dung dịch Fe2+ trên bằng dung dịch K2Cr2O7 thì thể tích dung dịch K2Cr2O7 0,02M cần dùng là:
A. 10 ml
B. 15 ml
C. 20 ml
D. 25 ml
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau:
Mg
2
+
/
Mg
;
Fe
2
+
/
Fe
;
Cu
2
+
/
Cu
;
Fe...
Đọc tiếp
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg 2 + / Mg ; Fe 2 + / Fe ; Cu 2 + / Cu ; Fe 3 + / Fe 2 + ; Ag + / Ag . Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là:
A. Mg , Fe , Cu
B. Mg , Fe 2 + , Ag
C. Mg , Cu , Cu 2 +
D. Fe , Cu , Ag +
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau:
M
g
2
+
/
M
g
;
F
e
2
+
/
F
e
;
C
u
2
+
/
C
u
;
F
e
3
+
/
F
e
2...
Đọc tiếp
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: M g 2 + / M g ; F e 2 + / F e ; C u 2 + / C u ; F e 3 + / F e 2 + ; A g + / A g . Dãy chỉ gồm các chất, ion tác dụng được với ion F e 3 + trong dung dịch là
A. Mg, F e 2 + , Ag.
B. Fe, Cu, A g + .
C. Mg, Cu, C u 2 + .
D. Mg, Fe, Cu.
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau:
M
g
2
+
/
M
g
;
F
e
2
+
/
F
e
;
C
u
2
+
C
u
;
F
e
3
+
/
F
e
2...
Đọc tiếp
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: M g 2 + / M g ; F e 2 + / F e ; C u 2 + C u ; F e 3 + / F e 2 + ; A g + / A g . Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là:
A. Mg, Fe, Cu.
B. Mg, Cu, C u 2 + .
C. Mg, F e 2 + , Ag.
D. Fe, Cu, A g + .
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau:
M
g
2
+
/
M
g
;
F
e
2
+
/
F
e
;
C
u
2
+
/
C
u
;
F
e
3
+
/
F
e
2...
Đọc tiếp
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: M g 2 + / M g ; F e 2 + / F e ; C u 2 + / C u ; F e 3 + / F e 2 + ; A g + / A g . Dãy chỉ gồm các chất, ion tác dụng được với ion F e 3 + trong dung dịch là
A. Mg, Fe, Cu.
B. Mg, Cu, C u 2 +
C. Mg, F e 2 + , Ag.
D. Fe, Cu, A g + .
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg2+/Mg; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là: A. Mg, Fe, Cu. B. Mg, Fe2+, Ag C. Mg, Cu, Cu2+. D. Fe, Cu, Ag+.
Đọc tiếp
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg2+/Mg; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag.
Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là:
A. Mg, Fe, Cu.
B. Mg, Fe2+, Ag
C. Mg, Cu, Cu2+.
D. Fe, Cu, Ag+.
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau:
M
g
2
+
/
M
g
;
F
e
2
+
/
F
e
;
C
u
2
+
/
C
u
;
F
e
3
+
/
F
e
2...
Đọc tiếp
Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: M g 2 + / M g ; F e 2 + / F e ; C u 2 + / C u ; F e 3 + / F e 2 + ; A g + / A g . Dãy chỉ gồm các chất, ion tác dụng được với ion F e 3 + trong dung dịch là
A. Fe, Cu, A g + .
B. Mg, F e 2 + , Ag.
C. Mg, Cu, C u 2 + .
D. Mg, Fe, Cu.
Trong các nhận định sau đây, có mấy nhận định đúng? 1. Cu có thể tan trong dung dịch Fe2(SO4)3. 2. Hỗn hợp gồm Cu, Fe2O3, Fe3O4 trong đó số mol Cu bằng tổng số mol Fe2O3 và Fe3O4 có thể tan hết trong dung dịch HCl dư. 3. Dung dịch AgNO3 không tác dụng được với dung dịch Fe(NO3)2. 4. Cặp oxi hóa khử MnO4-/Mn2+ có thế điện cực lớn hơn cặp Fe3+/Fe2+. A. (1), ( 2), ( 3), ( 4) B. (1), (2), (4) C. (1), (2) D. (1), ( 3)
Đọc tiếp
Trong các nhận định sau đây, có mấy nhận định đúng?
1. Cu có thể tan trong dung dịch Fe2(SO4)3.
2. Hỗn hợp gồm Cu, Fe2O3, Fe3O4 trong đó số mol Cu bằng tổng số mol Fe2O3 và Fe3O4 có thể tan hết trong dung dịch HCl dư.
3. Dung dịch AgNO3 không tác dụng được với dung dịch Fe(NO3)2.
4. Cặp oxi hóa khử MnO4-/Mn2+ có thế điện cực lớn hơn cặp Fe3+/Fe2+.
A. (1), ( 2), ( 3), ( 4)
B. (1), (2), (4)
C. (1), (2)
D. (1), ( 3)