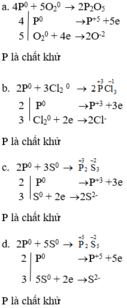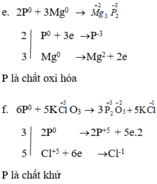Các câu hỏi tương tự
Ở nhiệt độ cao cacbon có thể phản ứng với nhiều đơn chất và hợp chất. Hãy lập các phương trình hoá học sau đây và cho biết ở phản ứng nào cacbon thể hiện tính khử. Ghi rõ số oxi hoá của cacbon trong từng phản ứng.
Viết phương trình hoá học của phản ứng tạo thành liti nitrua và nhóm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hoá hay chất khử?
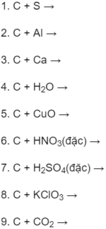
Cho các chất sau:
C
a
3
(
P
O
4
)
2
,
P
2
O
5
,
P
,
H
3...
Đọc tiếp
Cho các chất sau: C a 3 ( P O 4 ) 2 , P 2 O 5 , P , H 3 P O 4 , N a H 2 P O 4 , N H 4 H 2 P O 4 , N a 3 P O 4 , A g 3 P O 4 . Hãy lập một dãy biến hoá biểu diễn quan hộ giữa các chất trên. Viết các phương trình hoá học và nêu rõ phản ứng thuộc loại nào.
Hoàn thành các phương trình hoá học sau đây (ghi rõ số oxi hoá của cacbon :
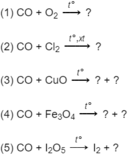
Trong các phản ứng này CO thể hiện tính chất gì ?
1. Cân bằng phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng : Fe + H2SO4 đặc,nóng → Fe2 (SO4)3 + SO2 + H2O KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O 2. Tính khối lượng CaF2 cần dùng để điều chế 2,5 kg dung dịch axit Flohidric nồng độ 40%. 3. Hòa tan 11 gam hỗn hợp bột sắt và nhôm trong dung dịch HCl thu được 8,96 lit khí (điều kiện tiêu chuẩn). a. Xác định thành phần phần trăm về khối lượng của mỗi kim loại tron...
Đọc tiếp
1. Cân bằng phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng :
Fe + H2SO4 đặc,nóng → Fe2 (SO4)3 + SO2 + H2O
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
2. Tính khối lượng CaF2 cần dùng để điều chế 2,5 kg dung dịch axit Flohidric nồng độ 40%.
3. Hòa tan 11 gam hỗn hợp bột sắt và nhôm trong dung dịch HCl thu được 8,96 lit khí (điều kiện tiêu chuẩn).
a. Xác định thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp. b. Tính thể tích dung dịch HCl 2M đã dùng.
(Cho Ca = 40; F = 19; H =1; Fe = 56; Al = 27)
Trong số các phản ứng hoá học dưới đây, phản ứng nào là phản ứng oxi hoá - khử ?
Cho các phát biểu sau : (1) Khoáng vật chính của photpho trong tự nhiên là pirit, apatit và photphoric. (2) Các số oxi hoá có thể có của photpho là –3; +3; +5; 0.(3) Tính chất hoá học điển hình của photpho là tính oxi hoá.(4) Trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P2O5 và H2O.(5) Trong điều kiện thường, photpho hoạt động hoá học mạnh hơn nitơ là do độ âm điện của photpho (2,1) nhỏ hơn của nitơ (3,0).Số phát biểu không đúng là: A. 2. B. 3. C. 4. D. 1.
Đọc tiếp
Cho các phát biểu sau :
(1) Khoáng vật chính của photpho trong tự nhiên là pirit, apatit và photphoric.
(2) Các số oxi hoá có thể có của photpho là –3; +3; +5; 0.
(3) Tính chất hoá học điển hình của photpho là tính oxi hoá.
(4) Trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P2O5 và H2O.
(5) Trong điều kiện thường, photpho hoạt động hoá học mạnh hơn nitơ là do độ âm điện của photpho (2,1) nhỏ hơn của nitơ (3,0).
Số phát biểu không đúng là:
A. 2.
B. 3.
C. 4.
D. 1.
4. Cân bằng phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng : Al + H2SO4 đặc,nóng Al2 (SO4)3 + SO2 + H2OMnO2 + HCl MnCl2 + Cl2 + H2O5. Tính khối lượng KMnO4 cần dùng để điều chế 1120 lít khí Clo (điều kiện tiêu chuẩn).6. Hòa tan 10,2 gam hỗn hợp bột magie và nhôm trong dung dịch HCl thu được 11,2 lit khí (điều kiện tiêu chuẩn).c. Xác định thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp.d. Tín...
Đọc tiếp
4. Cân bằng phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng :
Al + H2SO4 đặc,nóng Al2 (SO4)3 + SO2 + H2O
MnO2 + HCl MnCl2 + Cl2 + H2O
5. Tính khối lượng KMnO4 cần dùng để điều chế 1120 lít khí Clo (điều kiện tiêu chuẩn).
6. Hòa tan 10,2 gam hỗn hợp bột magie và nhôm trong dung dịch HCl thu được 11,2 lit khí (điều kiện tiêu chuẩn).
c. Xác định thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp.
d. Tính thể tích dung dịch HCl 2M đã dùng.
(Cho K = 39; Mn = 55; O =16; Mg = 24; Al = 27)
Anđehit benzoic
C
6
H
5
-
C
H
O
tác dụng với kiềm đậm đặc theo phương trình hoá học sau :2
C
6
H
5
-
C
H
O
(anđehit benzoic) + KOH →
C
6
H
5
C
O
O
K
(kali benzoat) +...
Đọc tiếp
Anđehit benzoic C 6 H 5 - C H O tác dụng với kiềm đậm đặc theo phương trình hoá học sau :
2 C 6 H 5 - C H O (anđehit benzoic) + KOH → C 6 H 5 C O O K (kali benzoat) + C 6 H 5 C H 2 O H (ancol benzylic)
Trong phản ứng này thì
A. anđehit benzoic chỉ bị oxi hoá.
B. anđehit benzoic chỉ bị khử.
C. anđehit benzoic không bị oxi hoá, không bị khử.
D. anđehit benzoic vừa bị oxi hoá, vừa bị khử.