Khi hoà tan 30,0g hỗn hợp đồng và đồng (II) oxit trong 1,5 lít dung dịch axit nitric 1,00M (loãng) thấy thoát ra 6,72 lit nitơ monooxit (đktc). Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích các dung dịch không thay đổi.
nHNO3 = 1,5. 1,00 = 1,50 (mol)
nNO = 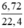 = 0,3(mol)
= 0,3(mol)
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo pt(1) nCu = 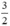 . nNO =
. nNO = 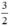 . 0,3 = 0,45 mol
. 0,3 = 0,45 mol
Gọi nCuO = x mol
Ta có: mhỗn hợp = mCu + mCuO = 0,45. 64 + 80x = 30,00
⇒ x = 0,015 ⇒ nCuO = 0,015 mol ⇒ mCuO = 0,015. 80 = 1,2 g
(Hoặc mCuO = 30 - 0,45. 64 = 1,2g)
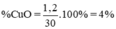
Theo pt(1) nCu(NO3)2 = nCu = 0,45 mol
Theo pt(2) nCu(NO3)2 = nCuO = 0,015 mol
⇒ Tổng nCu(NO3)2 = 0,45 + 0,015 = 0,465(mol)
CMCu(NO3)2 = 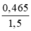 = 0,31(M)
= 0,31(M)
Theo pt (1) nHNO3 = 4. nNO = 4. 0,3 = 1,2 mol
Theo pt (2) nHNO3 = 2. nCuO= 2. 0,015 = 0,03 mol
nHNO3 (dư)= 1,5 - 1,2 – 0,03 = 0,27(mol)
CM HNO3 = 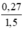 = 0,18(M)
= 0,18(M)





