Hỗn hợp M chứa 3 axit cacboxylic đơn chức mạch hở, trong đó hai chất là axit no kế tiếp nhau trong dãy đồng đẳng và một chất là axit không no có một liên kết kép ở gốc hiđrocacbon.
Cho 29,6 g M tác dụng với dung dịch NaOH rồi cô cạn, thu được 40,6 g hỗn hợp muối khan. Đốt cháy hoàn toàn 8,88 g M thu được 6,72 lít C O 2 (đktc).
Xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M.
Các axit đơn chức tác dụng với NaOH như sau :
RCOOH + NaOH → RCOONa + H 2 O
Cứ 1 mol RCOOH biến thành 1 mol RCOONa thì khối lượng tăng thêm: 23 - 1 = 22 (g).
Khi 29,6 g M biến thành hỗn hợp muối, khối lượng đã tăng thêm: 40,6 - 29,6= 11 (g).
Vậy số mol 3 axit trong 29,60 g M là : 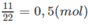
Khối lượng trung bình của 1 mol axit trong hỗn hợp là:
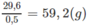
Vậy trong hỗn hợp M phải có axit có phân tử khối nhỏ hơn 59,2. Chất đó chỉ có thể là H-COOH. Nhưng M có 2 axit no kế tiếp nhau trong dãy đồng đẳng nên đã có HCOOH thì phải có C H 3 C O O H .
Giả sử trong 8,88 g M có x mol HCOOH, y mol C H 3 C O O H và z mol C n H 2 n - 1 C O O H :
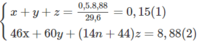
2HCOOH + O 2 → 2 C O 2 + 2 H 2 O
x mol x mol
C H 3 C O O H + 2 O 2 → 2 C O 2 + 2 H 2 O
y mol 2y mol
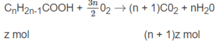
x + 2y + (n + 1)z = 0,3 (3)
Cách giải hệ phượng trình :
Nhân 2 vế của phương trình (3) với 14 ta có
14x + 28y + (14n + 14)z = 4,2 (3’)
Lấy (2) trừ đi (3') :
32x + 32y + 30z = 4 68 (2')
Nhân (1) với 30 ta có:
30x + 30y + 30z = 4,50 (1')
Lấy (2') trừ đi (1'): 2x + 2y = 0,18 ⇒ x + y = 0,09 ⇒ z = 0,15 - 0,09 = 0,06
Thay các giá trị vừa tìm được vào phương trình (3), ta có :
0,09 + y + 0,06(n + 1) = 0,3
y = 0,15 - 0,06n
0 < y < 0,09 ⇒ 0 < 0,15 - 0,06n < 0,09
1 < n < 2,5
⇒ n = 2 ; y = 0,15 - 0,06.2 = 0,03 ⇒ x = 0,06.
Thành phần khối lượng của hỗn hợp:
H-COOH( C H 2 O 2 ) axit metanoic là:

C H 3 -COOH( C 2 H 4 O 2 ) axit etanoic là

C H 2 = CH-COOH( C 3 H 4 O 2 ) axit propenoic là:




