Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại, 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lít khí H2 (đktc). Giá trị của t là:
A. 2267,75
B. 2895,10.
C. 2316,00.
D. 2219,40.
Đáp án A
Vì Mg + dung dịch X → N2O và NO ⇒ X có chứa HNO3.
+ Nhận thấy 0,036 gam hỗn hợp kim loại chính là Ag và Mg.
⇒ X chứa AgNO3 dư và nMg dư = 0,005 mol ⇒ nAg = 0,002 mol
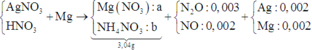
+ PT theo bảo toàn e ta có: 2nMg = nAg + 8nNH4+ + 8nN2O + 3nNO.
<=> 2a – 8b = 0,032 (1).
+ PT theo khối lượng muối: 148a + 80b = 3,04 (2).
+ Giải hệ (1) và (2) ⇒ nMg pứ = 0,02 và nNH4NO3 = 0,001.
⇒ Bảo toàn nitơ ta có nHNO3/X = 0,047 mol.
⇒ t = 0,047 × 96500 ÷ 2 = 2267,75s



