Có phương trình hóa học sau:
CaCO3 → CaO + CO2.
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2g CaO?
b) Muốn điều chế được 7g CaO cần dùng bao nhiêu gam CaCO3?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc).
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng.
Phương trình hóa học CaCO3 → CaO + CO2.
a) nCaO = 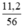 = 0,2 mol.
= 0,2 mol.
Theo PTHH thì nCaCO3 = nCaO = 0,2 (mol)
b) nCaO = 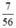 = 0,125 (mol)
= 0,125 (mol)
Theo PTHH thì nCaCO3 = nCaO = 0,125 (mol)
mCaCO3 = M.n = 100.0,125 = 12,5 (g)
c) Theo PTHH thì nCO2 = nCaCO3 = 3,5 (mol)
VCO2 = 22,4.n = 22,4.3,5 = 78,4 (lít)
d) nCO2 = 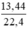 = 0,6 (mol)
= 0,6 (mol)
Theo PTHH nCaO = nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = n.M = 0,6.100 = 60 (g)
mCaO = n.M = 0,6.56 = 33,6 (g)











