Đáp án D
Số mol Fe là: n F e = 22 , 4 56 = 0 , 4 ( m o l )
Số oxi hóa các nguyên tố thay đổi là: F e 0 + O 2 0 → t 0 F e 3 + 8 / 3 O 4 - 2
Quá trình nhường electron:
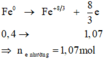
Đáp án D
Số mol Fe là: n F e = 22 , 4 56 = 0 , 4 ( m o l )
Số oxi hóa các nguyên tố thay đổi là: F e 0 + O 2 0 → t 0 F e 3 + 8 / 3 O 4 - 2
Quá trình nhường electron:
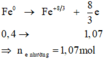
Cho phản ứng: Zn + CuCl2 → ZnCl2 + Cu.
Trong phản ứng này, 1 mol ion Cu2+;
A. đã nhận 1 mol electron.
B. đã nhận 2 mol electron.
C. đã nhường 1 mol electron.
D. đã nhường 2 mol electron.
Chọn đáp án đúng.
Cho Fe phản ứng với dung dịch H 2 SO 4 thu được khí A và 11,04 gam muối. Tính khối lượng Fe phản ứng biết rằng số mol Fe phản ứng bằng 37,5% số mol H 2 SO 4 phản ứng.
hòa tan hỗn hợp A gồm 32,4 g Al và 22,4 gam Cu vào dung dịch HNO3 dư phản sau phản ứng thu được 22,4 lít hỗn hợp khí X gồm NO,NO2,N2 có khối lượng là 35,8g.tính mol của NO,số mol của HNO3 đã phản ứng
cho m gam fe tan hết với dd hno3 thu được 6.72l no(đktc, sản phẩm khử duy nhất)và dung dịch X .số mol fe phản ứng bằng 32.5% số mol hno3 phản ứng . tính m và khối lượng fe(no3)3 trong dd X
Tính khối lượng a) 0,2 (mol) Fe+0,3 mol Cứ b) 0,5 (mol) H2SO4 Cho M . Fe=56, Cu=64, H=1, S=32, O=16 (Ai giúp mình với)
Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ mol x : y = 2 : 5 ), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hòa tan là:
A. 2x
B. 3x
C. 2y
D. y
Tính khối lượng của electron có trong 1kg Fe. Biết 1 mol nguyên tử Fe có khối lượng là 55,85g và số proton trong hạt nhân của Fe là 26.
A. 2,55.10-3 gam
B. 2,55.10-4 gam.
C. 0,255 gam.
D. 2,55.10-3kg.
Cho 0,672 gam Fe và 0,02 mol C l 2 tham gia phản ứng hoàn toàn với nhau. Khối lượng muối thu được là
A. 2,17 gam.
B. 1,95 gam.
C. 4,34 gam.
D. 3,90 gam.
Cân bằng các phản ứng sau theo phương pháp thăng bằng e(ghi điều kiện nếu có):
1. NH 3 + O 2 → NO + H 2 O
2. NH 3 + O 2 → N 2 + H 2 O
3. H 2 S + O 2 → S + H 2 O
4. P + KClO 3 → P 2 O 5 + KCl
5. Fe 2 O 3 + CO → Fe 3 O 4 + CO