Đáp án A
Ta có N2O4 (không màu, k) <=> 2NO2 (màu nâu đỏ, k) ∆H = 58kJ > 0
Khi ngâm ống 1 trong nước đá → giảm nhiệt độ → cân bằng chuyển dịch theo chiều nghịch (chiều phản ứng tỏa nhiệt)
→ Ống 1 có màu nhạt hơn → Chọn A.
Đáp án A
Ta có N2O4 (không màu, k) <=> 2NO2 (màu nâu đỏ, k) ∆H = 58kJ > 0
Khi ngâm ống 1 trong nước đá → giảm nhiệt độ → cân bằng chuyển dịch theo chiều nghịch (chiều phản ứng tỏa nhiệt)
→ Ống 1 có màu nhạt hơn → Chọn A.
Cho hỗn hợp khí gồm NO2 và N2O4 có tỉ lệ số mol là 1:1 vào 2 ống nghiệm nối với nhau. Đóng khóa K và ngâm ống 1 vào cốc nước đá. Màu của hỗn hợp khí trong ống 1 và ống 2 là:
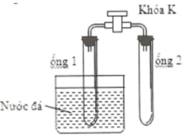
A. Ống 1 có màu nhạt hơn
B. Ống 1 có màu đậm hơn
C. Cả 2 ống đều không có màu
D. Cả 2 ống đều có màu nâu
Xét phản ứng : 2 N O 2 ( k ) ⇄ N 2 O 4 ( k ) . Tỉ khối hơi của hỗn hợp khí thu được so với H 2 ở nhiệt độ t 1 là 27,6 ; ở nhiệt độ t 2 là 34,5 t 1 > t 2 . Có 3 ống nghiệm đựng khí N O 2 (có nút kín). Sau đó : Ngâm ống thứ nhất vào cốc nước đá ; ngâm ống thứ hai vào cốc nước sôi ; ống thứ ba để ở điều kiện thường. Một thời gian sau, ta thấy
A. ống thứ nhất có màu đậm nhất, ống thứ hai có màu nhạt nhất
B. ống thứ nhất có màu nhạt nhất, ống thứ hai có màu đậm nhất
C. ống thứ nhất có màu đậm nhất, ống thứ ba có màu nhạt nhất
D. ống thứ nhất có màu đậm nhất, ống thứ hai và ống thứ ba đều có màu nhạt hơn
Trong phòng thí nghiệm người ta điều chế N O 2 bằng cách cho Cu tác dụng với H N O 3 đặc, đun nóng. N O 2 có thể chuyển thành N 2 O 4 theo cân bằng :
2 N O 2 ⇄ N 2 O 4
Cho biết NO2 là khí có màu nâu và N 2 O 4 là khí không màu. Khi ngâm bình chứa N O 2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là
A. Toả nhiệt
B. Thu nhiệt
C. Không toả hay thu nhiệt
D. Một phương án khác
Chuẩn bị 4 ống nghiệm được đánh dấu theo thứ tự (1), (2), (3), (4). Cho vào mỗi ống nghiệm 3 ml dung dịch H 2 S O 4 15%. Đun nóng dung dịch trong ống nghiệm (3), (4), sao đó cho vào ống nghiệm (1) và (3), mỗi ống nghiệm 0,5 gam kẽm hạt, cho vào ống nghiệm (2) và (4), mỗi ống nghiệm 0,5 gam kẽm bột. Ống nghiệm có khí thoát ra nhanh nhất là
A. (1)
B. (2)
C. (3)
D. (4)
Đun nóng một hỗn hợp gồm có 0,650g bột kẽm và 0,224g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng, người ta thu được chất nào trong ống nghiệm? Khối lượng là bao nhiêu?
Trong thí nghiệm ở hình bên người ta dẫn khí clo điều chế từ mangan dioxit rắn và dung dịch axit clohidric đậm đặc khi đã loại bỏ khí hidro clorua vào ống hình trụ A có đặt một miếng giấy màu.
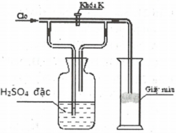
Phát biểu nào sau đây không đúng?
A. Đóng khoá K thì miếng giấy không mất màu
B. Mở khoá K thì miếng giấy mất
C. H2SO4 đặc có vai trò giữ hơi H2O có lẫn trong khí Cl2
D. Mở khoá K thì miếng giấy chuyển thành màu đỏ
Trong một bình kín đựng khí NO2 có màu nâu đỏ. Ngâm bình trong nước đá, thấy màu nâu nhạt đần. Đã xảy ra phản ứng hóa học:
2 N O 2 ( k ) ⇋ N 2 O 4 ( k )
nâu đỏ không màu
Điều khẳng định nào sau đây về phản ứng hóa học trên là sai
A. Phản ứng thuận là phản ứng theo chiều giảm số mol khí
B. Phản ứng thuận là phản ứng thu nhiệt
C. Phản ứng nghịch là phản ứng thu nhiệt
D. Khi ngâm bình trong nước đá, cân bằng hóa học chuyển dịch sang chiều thuận
Trong một bình kín đựng khí NO2 có màu nâu đỏ. Ngâm bình trong nước đá, thấy màu nâu nhạt dần. Đã xảy ra phản ứng hóa học: 2NO2(k) ⇔ N2O4(k)
nâu đỏ không màu
Điều khẳng định nào sau đây về phản ứng hóa học trên là sai ?
A. Phản ứng thuận là phản ứng theo chiều giảm số mol khí.
B. Phản ứng thuận là phản ứng thu nhiệt.
C. Phản ứng nghịch là phản ứng thu nhiệt.
D. Khi ngâm bình trong nước đá, cân bằng hóa học chuyển dịch sang chiều thuận.
Cho hệ cân bằng trong bình kín:
2NO2 (khí, màu nâu đỏ) ⇄ N2O4 (khí, không màu)
Biết rằng khi làm lạnh hệ phản ứng thì thấy màu của hỗn hợp khí trong bình nhạt hơn. Các yếu tố tác động vào hệ cân bằng trên đều làm cho cân bằng hóa học chuyển dịch theo chiều nghịch là:
A. Tăng nhiệt độ, cho thêm chất xúc tác.
B. Giảm nhiệt độ, giảm áp suất.
C. Tăng nhiệt độ, giảm áp suất.
D. Tăng nhiệt độ, tăng áp suất.