Các câu hỏi tương tự
Câu 6: Ở trạng thái cơ bản, nguyên tử X có 7 electron thuộc các phân lớp s. Hãy cho biết cấu hình đúng của X là:A. 1s2 2s2 2p6 3s2 3p6 4s1 B. 1s2 2s2 2p6 3s2 3p6 3d5 4s1C. 1s2 2s2 2p6 3s2 3p6 3d10 4s1 D. Cả 3 trường hợp đều thỏa mãn.
Đọc tiếp
Câu 6: Ở trạng thái cơ bản, nguyên tử X có 7 electron thuộc các phân lớp s. Hãy cho biết cấu hình đúng của X là:
A. 1s2 2s2 2p6 3s2 3p6 4s1 B. 1s2 2s2 2p6 3s2 3p6 3d5 4s1
C. 1s2 2s2 2p6 3s2 3p6 3d10 4s1 D. Cả 3 trường hợp đều thỏa mãn.
7 Cấu hình eletron lớp ngoài cùng của ion âm là 3s2 3p6 thì cấu hình electron của nguyên tư tạo ra ion đó có thể là (I) 1s2 2s2 2p6 3s2 (IV) 1s2 2s2 2p6 3s2 3p4 (II) 1s2 2s2 2p6 3s2 3p5 (V) 1s2 2s2 2p5(III) 1s2 2s2 2p6 3s1 (VI) 1s2 2s2 2p4
Đọc tiếp
7 Cấu hình eletron lớp ngoài cùng của ion âm là 3s2 3p6 thì cấu hình electron của nguyên tư tạo ra ion đó có thể là
(I) 1s2 2s2 2p6 3s2 (IV) 1s2 2s2 2p6 3s2 3p4
(II) 1s2 2s2 2p6 3s2 3p5 (V) 1s2 2s2 2p5
(III) 1s2 2s2 2p6 3s1 (VI) 1s2 2s2 2p4
Cho cấu hình electron của các nguyên tố sauX: 1s2 2s2 2p6 3s2 ; Y: 1s2 2s2 2p6 3s2 3p1 ; Z: 1s2 2s2 2p6 3s2 3p6 3d3 4s2 ; T: 1s2 2s2 2p4.Dãy các cấu hình electron của các nguyên tố kim loại làAY, Z, T.BX, Y, T.CX, Y, Z.DX, Z, T.
Đọc tiếp
Cho cấu hình electron của các nguyên tố sau
X: 1s2 2s2 2p6 3s2 ; Y: 1s2 2s2 2p6 3s2 3p1 ; Z: 1s2 2s2 2p6 3s2 3p6 3d3 4s2 ; T: 1s2 2s2 2p4.
Dãy các cấu hình electron của các nguyên tố kim loại là
A
Y, Z, T.
B
X, Y, T.
C
X, Y, Z.
D
X, Z, T.
Hãy viết cấu hình electron nguyên tử của các nguyên tố sau đây : O, F, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử O, F, mỗi nguyên tử nhận thêm mấy electron thì có cấu hình electron giống như của khí hiếm Ne đứng sau.
Hãy cho biết tại sao các nguyên tử phi kim lại có khuynh hướng nhận thêm electron để trở thành các ion âm ?
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Nguyên tử flo có số hiệu nguyên tử là 9. Cấu hình electron của anion F- là ?
A.1s2 2s2 2p5 .
B.1s2 2s2 2p6 3s2 3p5 .
C.1s2 2s2 2p6 3s2 3p6 .
D.1s2 2s2 2p6
Cho nguyên tử các nguyên tố sau: K (Z = 19), Ca (Z = 20), Al (Z = 13), F (Z =9), Br (Z = 35). Viết cấu hình e và quá trình hình thành ion tương ứng của các nguyên tử trên.
Cấu hình electron của nguyên tử X là 1s2 2s2 2p6 3s2 3p6 3d6 4s2. X thuộc loại nguyên tố
A. s. B. p. C.d. D. F.
Dãy gồm nguyên tử X và các ion
Y
2
+
,
Z
-
đều có cấu hình electron phân lớp ngoài cùng
3
p
6
là:
Đọc tiếp
Dãy gồm nguyên tử X và các ion Y 2 + , Z - đều có cấu hình electron phân lớp ngoài cùng 3 p 6 là:
![]()
![]()
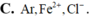
![]()
Dãy gồm nguyên tử X và các ion Y2+, Z– đều có cấu hình electron phân lớp ngoài cùng 3p6 là : A. Ne, Mg2+, F– B. Ne, Ca2+, Cl– C. Ar, Fe2+, Cl– D. Ar, Ca2+, Cl–
Đọc tiếp
Dãy gồm nguyên tử X và các ion Y2+, Z– đều có cấu hình electron phân lớp ngoài cùng 3p6 là :
A. Ne, Mg2+, F–
B. Ne, Ca2+, Cl–
C. Ar, Fe2+, Cl–
D. Ar, Ca2+, Cl–








