Đây là phiên bản do Song Ngư
đóng góp và sửa đổi vào 30 tháng 8 2021 lúc 19:54. Xem phiên bản hiện hành
Bài 2. Một số oxit quan trọng
Nội dung lý thuyết
Các phiên bản khác
1
2 gp
A. CANXI OXIT ( CaO – Vôi sống )
1. Tính chất vật lý
- Là chất rắn màu trắng. Nóng chảy với nhiệt độ cao 2585\(^o\)C
- Là một Oxit Bazơ mang đầy đủ tính chất hóa học của một Oxit Bazơ.
2. Tính chất hóa học
a) Tác dụng với nước \(\rightarrow\) Dung dịch Bazơ
CaO + H2O \(\rightarrow\) Ca(OH)2
à Quỳ tím chuyển sang màu xanh.
à Phenolphthalein chuyển sang màu đỏ.
(Phênolphtalêin hay còn viết là Phenolphthalein (theo tiếng Anh), được ứng dụng trong phân tích hóa học với vai trò như một loại thuốc thử để xác định điểm tương đương trong các phản ứng trung hòa hay chuẩn độ axit – bazơ)
b) Tác dụng với dung dịch Axit Muối + nước
CaO + H2SO4 \(\rightarrow\) CaSO4 + H2O
c) Tác dụng với Oxit Axit \(\rightarrow\) Muối
CaO + CO2 \(\rightarrow\) CaCO3
3. Sản xuất
- Nhiên liệu: Đá vôi, than đá.
- Nguyên tắc:
C + O2 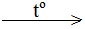 CO2 + Q (nhiệt lượng)
CO2 + Q (nhiệt lượng)
CaCO3 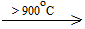 CaO + CO2
CaO + CO2
B. Lưu huỳnh Đioxit (Khí Sunfurơ) – SO2
1. Tính chất vật lý
- Là chất khí không màu, mùi hắc, độc, gây ho, gây viêm đường hô hấp, nặng hơn không khí.
2. Tính chất hóa học – Mang đầy đủ tính chất hóa học của một Oxit Bazơ.
a) Tác dụng với H2O \(\rightarrow\) Dung dịch Axit
SO2 + H2O \(\rightarrow\) H2SO3
à Quỳ tím chuyển sang màu đỏ
b) Tác dụng với Bazơ
SO2 + Ca(OH)2 \(\rightarrow\) CaSO3 + H2O
c) Tác dụng với Oxit Bazơ
SO2 + Na2O \(\rightarrow\) Na2SO3
* SO3 thể hiện tính khử
SO2 + Cl2 + 2H2O \(\rightarrow\) 2HCl + H2SO4
SO2 + Br2 + 2H2O \(\rightarrow\) 2HBr + H2SO4
2SO2 + H2S \(\rightarrow\) H2SO4 + 2S
3. Sản xuất
a) Đốt cháy S
S + O2 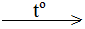 SO2
SO2
b) Đốt quặng Firit Sắt
FeS2 + O2 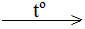 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
c) Cho kim loại + H2SO4 đặc nóng
Cu + H2SO4 đặc 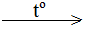 CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
d) Cho muối Sunfit + Axit
CaSO3 + 2HCl \(\rightarrow\) CaCl2 + H2O + SO2
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn