Bài 4. Một số axit quan trọng
Nội dung lý thuyết
A. AXIT CLOHIĐRIC (HCl)
I. Tính chất
1. Tính chất vật lý
- Dung dịch khí hidro clorua tan trong nước gọi là axit clohidric.
- Dung dịch HCl đậm đặc là dung dịch bão hòa hiđroclorua, có nồng độ khoảng 37%, từ đây ta có thể pha chế thành dung dịch HCl có nồng độ khác nhau.
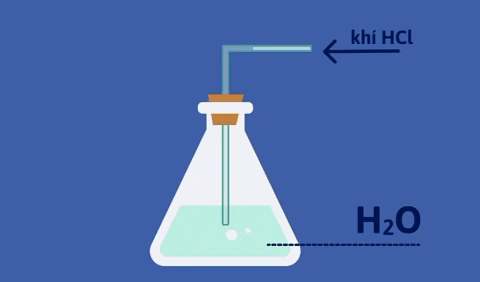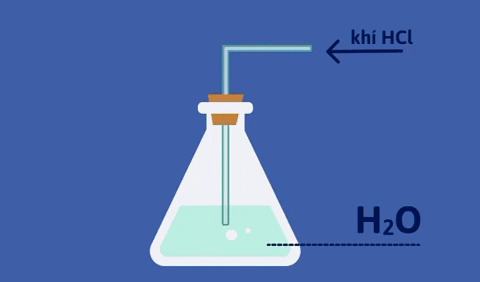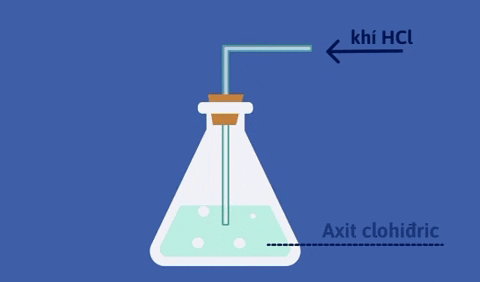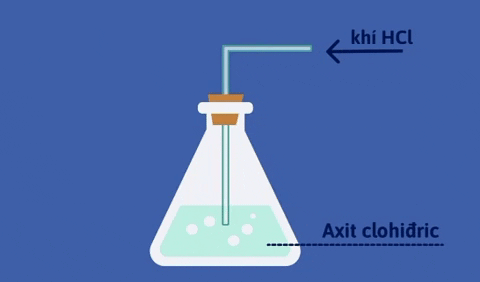
@226249@
2. Tính chất hóa học
HCl là một axit mạnh, có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu chất chỉ thị
Axit HCl làm đổi màu giấy quỳ tím thành đỏ.
- Tác dụng với kim loại
Axit HCl tác dụng với nhiều kim loại đứng trước hidro trong dãy hoạt động hóa học (Mg, Al, Zn, Fe,...) tạo thành muối clorua và giải phóng khí hiđro.
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
- Tác dụng với bazơ tạo thành muối và nước.
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + H2O
- Tác dụng với oxit bazơ tạo thành muối clorua và nước.
2HCl + BaO → BaCl2 + H2O
Ngoài ra, axit clohiđric còn tác dụng với muối (tính chất này sẽ học ở bài 9).
@226467@@226586@
II. Ứng dụng
- Điều chế các muối clorua.
- Làm sạch bề mặt kim loại trước khi hàn.
- Tẩy gỉ kim loại trước khi sơn, tráng, mạ kim loại.

- Dùng trong chế biến thực phẩm, dược phẩm...
B. AXIT SUNFURIC (H2SO4)
I. Tính chất vật lí
Axit sunfuric H2SO4 là chất lỏng sánh, không màu, nặng gấp hai lần nước, không bay hơi, tan dễ dàng trong nước và tỏa nhiều nhiệt.
Chú ý: Axit sunfuric H2SO4 đặc khi tan trong nước tạo ra một lượng nhiệt rất lớn. Nếu đổ nước vào dung dịch axit H2SO4 đặc, nước sẽ sôi đột ngột kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Cho nên khi muốn pha loãng dung dịch axit H2SO4 đặc tan phải đổ từ từ dung dịch axit chảy dọc theo đũa thủy tinh vào nước, khuấy đều. Tuyệt đối không làm ngược lại.
.gif)
.gif)
a) Cách pha loãng không an toàn b) Cách pha loãng an toàn (cho từ từ H2SO4 vào nước)
@226728@
II. Tính chất hóa học
Axit sunfuric loãng và axit sunfuric đặc có một số tính chất hóa học khác nhau.
1. Tính chất hóa học của axit H2SO4 loãng
Tương tự axit clohiđric HCl, axit sunfuric H2SO4 loãng có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu quỳ tím thành đỏ.
- Tác dụng với nhiều kim loại đứng trước hidro trong dãy hoạt động hóa học (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
.gif)
Fe + H2SO4 loãng → FeSO4 + H2
- Tác dụng với bazơ tạo thành muối sunfat và nước.
H2SO4 loãng + Cu(OH)2 → CuSO4 + 2H2O
- Tác dụng với oxit bazơ tạo thành muối sunfat và nước.
3H2SO4 loãng + Fe2O3 → Fe2(SO4)3 + 3H2O
Ngoài ra axit sunfuric loãng còn tác dụng được với muối (học ở bài 9).
2. Tính chất hóa học riêng của axit sunfuric đặc
a. Tác dụng với kim loại
Axit H2SO4 đặc tác dụng với nhiều kim loại nhưng không giải phóng khí hiđro. Sản phẩm tạo thành là muối sunfat (hóa trị cao nhất).
Cu + 2H2SO4 đặc,nóng → CuSO4 + SO2↑ + H2O
2Fe + 6H2SO4 đặc,nóng → Fe2(SO4)3 + 3SO2↑ + 6H2O
a. Tính háo nước.
Thí nghiệm: Phản ứng giữa H2SO4 đặc và đường.
Hiện tượng: Màu trắng của đường chuyển sang màu vàng nâu rồi cuối cùng chuyển thành khối đen xốp bị bọt khí đẩy lên khỏi miệng cốc. Phản ứng tỏa rất nhiều nhiệt.
Giải thích: Chất rắn màu đen là cacbon, thành phần của đường gồm 3 nguyên tố C, H, O, H2SO4 đặc đã loại bỏ đi hai nguyên tố (có trong thành phần của nước) là H và O ra khỏi đường. Dó đó, người ta nói rằng H2SO4 đặc có tính háo nước:
C12H22O11 12C + 11H2O
Sau đó, một phần C vừa sinh ra lại bị H2SO4 đặc oxi hóa thành khí CO2 và SO2 bay lên kéo theo C dâng lên miệng cốc.
@226879@
III. Ứng dụng
Hàng năm, thế giới sản xuất hơn 200 triệu tấn axit H2SO4 . Axit H2SO4 là nguyên liệu của nhiều ngành sản xuất hóa học như sản xuất phân bón, phẩm nhuộm, chế biến dầu mỏ,...
.gif)
IV. Sản xuất axit H2SO4
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước.
Quá trình sản xuất axit H2SO4 gồm 3 công đoạn sau:
- Sản xuất lưu huỳnh đi oxit bằng cách đốt lưu huỳnh hoặc pirit sắt trong không khí:
S + O2 SO2
Hoặc 4FeS2 + 11O2 8SO2 + 2Fe2O3
- Sản xuất lưu huỳnh trioxit bằng cách oxi hóa SO2, có xúc tác là V2O5 ở 450oC:
2SO2 + O2 \(\underrightarrow{V_2O_5,t^o}\) 2SO3
- Sản xuất axit H2SO4 bằng cách cho SO3 tác dụng với nước:
SO3 + H2O → H2SO4

V. Nhận biết axit H2SO4 và muối sunfat
Thuốc thử đển nhận biết axit sunfuric và muối sunfat là dung dịch muối bari như bari clorua BaCl2, bari nitrat Ba(NO3)2 hoặc dùng bari hidroxit Ba(OH)2. Hiện tượng để nhận biết là phản ứng tạo kết tủa màu trắng BaSO4 không tan trong nước và axit.
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
Để phân biệt axit sunfuric và muối sunfat, ta có thể dụng một số kim loại như Mg, Zn, Al, Fe...
@226948@
1. Dung dịch HCl và H2SO4 loãng có đầy đủ những tính chất hóa học của axit.
2. Axit sunfuric đặc tác dụng với nhiều kim loại, không giải phóng khí hidro và có tính háo nước.
3. Axit clohiđric và axit sunfuric có vai trò quan trọng trong nền kinh tế quốc dân.
4. Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc.
5. Nhận biết axit sunfuric và dung dịch muối sunfat bằng thuốc thử là dung dịch muối bari hoặc bari hidroxit.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé . Chúc các em học tốt!