Hoà tan hoàn toàn 10,55g hỗn hợp Al và Zn trong dung dịch H2SO4 đặc dư, nhiệt độ thu được 7,28l SO2. Tính %mAl
Bài 39: Luyện tập về tốc độ phản ứng và cân bằng hóa học
\(n_{SO_2} = \dfrac{7,28}{22,4} = 0,325(mol)\\ n_{Al} = a(mol) ; n_{Zn} = b(mol) \Rightarrow 27a + 65b = 10,55(1)\\ \text{Bảo toàn electron :}\\ 3a + 2b = 0,325.2(2)\\ (1)(2) \Rightarrow a = 0,15 ; b = 0,1\\ \%m_{Al} = \dfrac{0,15.27}{10,55}.100\% = 38,39\%\)
Đúng 1
Bình luận (1)
Hãy cho biết dãy chất nào sau đây tác dụng với dd HF? và viết pt
A. NaClO ,NaOH,SiO2
B. NaCl,SiO2,NaAlO2
C. NaNO3,Na2S,NaClO
D. NaOH,Na2SO4,CO2
Từ câu 01 đến 05( chuỗi hóa học).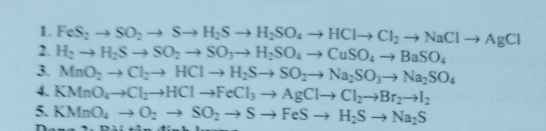
1/
\(4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2\\ SO_2 + 2H_2S \to 3S + 2H_2O\\ S + H_2 \xrightarrow{t^o,xt} H_2S\\ H_2S + 4Br_2 + 4H_2O \to 8HBr + H_2SO_4\\ H_2SO_4 + NaCl \xrightarrow{t^o} NaHSO_4 + HCl\\ MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O\\ 2Na +C l_2 \xrightarrow{t^o} 2NaCl\\ NaCl + AgNO_3 \to AgCl + NaNO_3\)
2/
\(S + H_2 \xrightarrow{t^o} H_2S\\ H_2S + \dfrac{3}{2}O_2 \xrightarrow{t^o} SO_2 + H_2O\\ 2SO_2 +O_2 \xrightarrow{t^o,xt} 2SO_3\\ SO_3 + H_2O \to H_2SO_4\\ CuO + H_2SO_4 \to CuSO_4 + H_2O\\ CuSO_4 + BaCl_2 \to BaSO_4 + CuCl)2\)
Đúng 1
Bình luận (0)
1)
4FeS2 + 11O2 -to-> 2Fe2O3 + 8SO2
SO2 + 2H2S -to-> 3S + 2H2O
S + H2 -to-> H2S
H2S + 4Br2 + 4H2O => H2SO4 + 8HBr
BaCl2 + H2SO4 => BaSO4 + 2HCl
2HCl-dp-> H2 + Cl2
Na + 1/2Cl2 -to-> NaCl
NaCl + AgNO3 => AgCl + NaNO3
2)
H2 + S -to-> H2S
2H2S + 3O2 -to-> 2SO2 + 2H2O
SO2 + 1/2O2 -to,V2O5-> SO3
SO3 + H2O => H2SO4
H2SO4 + CuO => CuSO4 + H2O
CuSO4 + BaCl2 => BaSO4 + CuCl2
Đúng 1
Bình luận (0)
3)
MnO2 + 4HCl(đ) -to-> MnCl2 + Cl2 + 2H2O
Cl2 + H2 -as-> 2HCl
FeS + 2HCl => FeCl2 + H2S
2H2S + 3O2 -to-> 2SO2 + 2H2O
2NaOH + SO2 => Na2SO3 + H2O
Na2SO3 + H2SO4 => Na2SO4 + SO2 + H2O
4)
2KMnO4 + 16HCl(đ) => 2KCl + 2MnCl2 + 5Cl2 +8H2O
Cl2 + H2 -as-> 2HCl
Fe(OH)3 + 3HCl => FeCl3 + 3H2O
FeCl3 + 3AgNO3 => Fe(NO3)3 + 3AgCl
AgCl -to-> Ag + 1/2Cl2
2NaBr + Cl2 => 2NaCl + Br2
2NaI + Br2 => 2NaBr + I2
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Từ câu 01 đến câu 02.
Bài 1 :
\(n_{Mg}=a\left(mol\right),n_{Zn}=b\left(mol\right)\)
\(m_{hh}=24a+65b=31.5\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{17.92}{22.4}=0.8\left(mol\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=a+b=0.8\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.5,b=0.3\)
\(m_{Mg}=0.5\cdot24=12\left(g\right)\)
\(m_{Zn}=0.3\cdot19.5\left(g\right)\)
\(n_{H_2SO_4}=n_{H_2}=0.8\left(mol\right)\)
\(C\%H_2SO_4=\dfrac{0.8\cdot98}{300}\cdot100\%=26.13\%\)
Đúng 1
Bình luận (0)
Từ câu 04 đến câu 05.
Bài 5 :
n Cu = a(mol) ; n Al = b(mol) ; n Mg = c(mol)
=> 64a + 27b + 24c = 11,5(1)
2Al + 6HCl $\to$ 2AlCl3 + 3H2
Mg + 2HCl $\to$ MgCl2 + H2
Theo PTHH :
n H2 = 1,5b + c = 5,6/22,4 = 0,25(2)
Bảo toàn electron :
2n SO2 = 2n Cu
2.0,1 = 2a (3)
Từ (1)(2)(3) suy ra a = 0,1 ; b = 0,1 ; c = 0,1
Vậy :
m Cu = 0,1.64 = 6,4 gam
m Al = 0,1.27 = 2,7 gam
m Mg = 0,1.24 = 2,4 gam
Đúng 2
Bình luận (0)
Từ câu 06 đến câu 07.
Bài 6 :
a) n Mg = a(mol) ; n Fe = b(mol) => 24a + 56b = 6,8(1)
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
Theo PTHH : n H2 = a + b = 3,36/22,4 = 0,15(2)
(1)(2) => a = 0,05 ; b = 0,1
%m Mg = 0,05.24/6,8 .100% = 17,65%
%m Fe = 100% -17,65% = 82,35%
b) Bảo toàn e :
2n Mg + 3n Fe = 2n SO2
=> n SO2 = (0,05.2 + 0,1.3)/2 = 0,2 mol
=> V SO2 = 0,2.22,4 = 4,48(lít)
Đúng 1
Bình luận (0)
Bài 7 :
\(n_{H_2SO_4}=\dfrac{100\cdot10^6\cdot98}{100\cdot98}=10^6\left(mol\right)\)
\(n_{FeS_2}=\dfrac{10^6}{2}=5\cdot10^5\left(mol\right)\)
\(n_{FeS_2\left(tt\right)}=\dfrac{5\cdot10^5\cdot120}{75\%}=80\left(tấn\right)\)
Đúng 0
Bình luận (0)
Câu 7 :
n H2SO4 = 100.1000.98%/98 = 1000(kmol)
Bảo toàn nguyên tố với S :
n FeS2 pư = 1/2 n H2SO4 = 500(kmol)
n FeS2 đã dùng = 500/75% = 2000/3(kmol)
m FeS2 = 120 . 2000/3 = 80 000(kg)
m pirit = 80 000/10% = 800 000(kg)
Đúng 0
Bình luận (0)
Từ câu 08 đến câu 10.
Bài 8 :
Coi Oxit sắt gồm Fe(x mol) và O(y mol)
=> 56x + 16y = 36(1)
n SO2 = 5,6/22,4 = 0,25(mol)
Bảo toàn electron :
3n Fe = 2n SO2 + 2n O
<=> 3a - 2b = 0,5(2)
Từ(1)(2) suy ra a = 0,5 ; b = 0,5
n Fe / n O = 0,5/0,5 = 1/1
Vậy oxit sắt là FeO
Đúng 1
Bình luận (0)
Bài 8 :
CT : FexOy
\(n_{SO_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(xFe^{\dfrac{2y}{x}}\rightarrow xFe^{3+}+\left(3x-2y\right)e\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(BTe:\)
\(n_{Fe_xO_y}=\dfrac{0.5}{3x-2y}\left(mol\right)\)
\(M=\dfrac{36}{\dfrac{0.5}{3x-2y}}=72\left(3x-2y\right)\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow56x+16y=72\cdot\left(3x-2y\right)\)
\(\Leftrightarrow160x=160y\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{1}{1}\)
\(CT:FeO\)
Đúng 1
Bình luận (0)
Câu 9 :
n S = 3,2/32 = 0,1(mol)
n SO2 = 13,44/22,4 = 0,6(mol)
Bảo toàn e với cả quá trình :
\(Fe^0 \to Fe^{3+} + 3e\\ S^0 \to S^{+6} + 6e\\ S^{+6} + 2e \to S^{+4}\)
Ta có: 3n Fe + 6n S = 2n SO2
<=> n Fe = (0,6.2 - 0,1.6)/3 = 0,2(mol)
<=> m = 0,2.56 = 11,2(gam)
Đúng 1
Bình luận (0)
Giải chi tiết.
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=22,8\) (1)
Ta có: \(n_{SO_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,7\cdot2=1,4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,3\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,25\cdot24}{22,8}\cdot100\%\approx26,32\%\\\%m_{Fe}=73,68\%\end{matrix}\right.\)
b) PTHH: \(2NaOH+H_2SO_{4\left(dư\right)}\rightarrow Na_2SO_4+2H_2O\)
Theo PTHH: \(n_{H_2SO_4\left(dư\right)}=\dfrac{1}{2}n_{NaOH}=\dfrac{0,4\cdot3}{2}=0,6\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,15\left(mol\right)\\n_{MgSO_4}=n_{Mg}=0,25\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{H_2SO_4\left(p/ứ\right)}=n_{MgSO_4}+3n_{Fe_2\left(SO_4\right)_3}+n_{SO_2}=1,4\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4}=1,4+0,6=2\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{2\cdot98}{98\%}=200\left(g\right)\)
Đúng 1
Bình luận (0)
Giải chi tiết.
Câu 1 :
\(2KMnO_4+16HCl_{\left(đ\right)}\underrightarrow{^{t^0}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(H_2+Cl_2\underrightarrow{^{as}}2HCl\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Đúng 2
Bình luận (0)
Câu 2 :
\(n_{Mg}=a\left(mol\right),n_{Zn}=b\left(mol\right)\)
\(m_{hh}=24a+65b=14.55\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=a+b=0.35\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.15\)
\(\%m_{Mg}=\dfrac{0.2\cdot24}{14.55}\cdot100\%=33.98\%\)
\(\%m_{Zn}=100-33.98=67.01\%\)
Đúng 2
Bình luận (0)
Câu 3 :
\(m_{FeS_2}=187.5\cdot80\%=150\left(kg\right)\)
\(n_{FeS_2}=\dfrac{150\cdot10^3}{120}=1250\left(mol\right)\)
\(n_{H_2SO_4}=2n_{FeS_2}=1250\cdot2=2500\left(mol\right)\)
\(n_{H_2SO_4\left(tt\right)}=2500\cdot90\%=2250\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{2250\cdot98\cdot100}{98}=225000\left(g\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{225000}{1.84}=122282\left(ml\right)=122.282\left(l\right)\)
Đúng 1
Bình luận (0)












