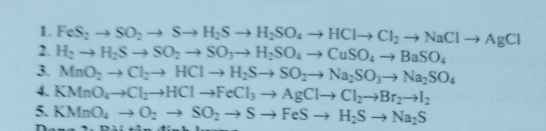Bài 6 :
a) n Mg = a(mol) ; n Fe = b(mol) => 24a + 56b = 6,8(1)
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
Theo PTHH : n H2 = a + b = 3,36/22,4 = 0,15(2)
(1)(2) => a = 0,05 ; b = 0,1
%m Mg = 0,05.24/6,8 .100% = 17,65%
%m Fe = 100% -17,65% = 82,35%
b) Bảo toàn e :
2n Mg + 3n Fe = 2n SO2
=> n SO2 = (0,05.2 + 0,1.3)/2 = 0,2 mol
=> V SO2 = 0,2.22,4 = 4,48(lít)
Bài 7 :
\(n_{H_2SO_4}=\dfrac{100\cdot10^6\cdot98}{100\cdot98}=10^6\left(mol\right)\)
\(n_{FeS_2}=\dfrac{10^6}{2}=5\cdot10^5\left(mol\right)\)
\(n_{FeS_2\left(tt\right)}=\dfrac{5\cdot10^5\cdot120}{75\%}=80\left(tấn\right)\)
Câu 7 :
n H2SO4 = 100.1000.98%/98 = 1000(kmol)
Bảo toàn nguyên tố với S :
n FeS2 pư = 1/2 n H2SO4 = 500(kmol)
n FeS2 đã dùng = 500/75% = 2000/3(kmol)
m FeS2 = 120 . 2000/3 = 80 000(kg)
m pirit = 80 000/10% = 800 000(kg)