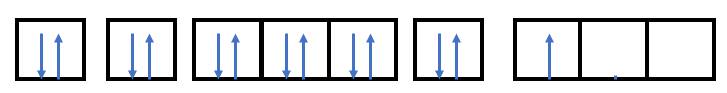
Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.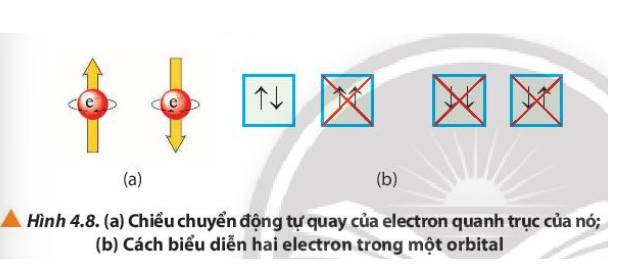
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Câu hỏi 9 (SGK Chân trời sáng tạo trang 30)
Thảo luận (2)
Câu hỏi 10 (SGK Chân trời sáng tạo trang 30)
Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi và bao nhiêu electron độc thân.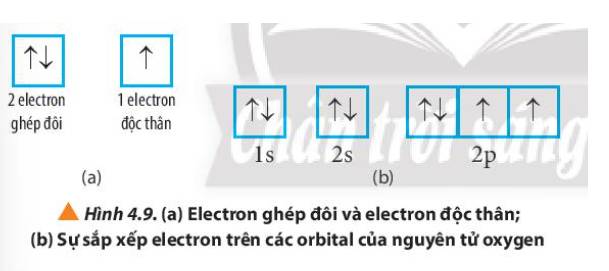
Thảo luận (2)Hướng dẫn giải- Nguyên tử oxygen có:
+ 6 electron ghép đôi nằm ở orbital 1s, 2s và 1 orbital 2p
+ 2 electron độc thân nằm ở 2 orbital 2p
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 11 (SGK Chân trời sáng tạo trang 31)
Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp.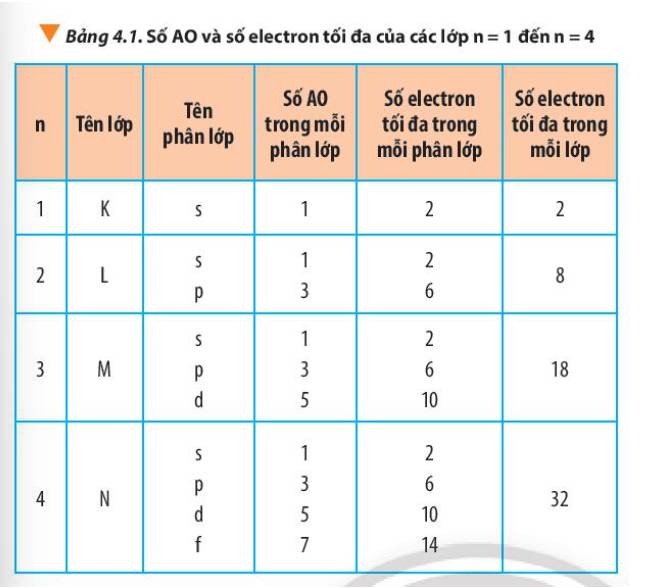
Thảo luận (1)Hướng dẫn giải- Lớp 1 có tối đa 2 electron = 2.12
- Lớp 2 có tối đa 8 electron = 2.22
- Lớp 3 có tối đa 18 electron = 2.32
- Lớp 4 có tối đa 32 electron = 2.42
=> Số electron tối đa trong lớp n là 2n2
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Vận dụng (SGK Chân trời sáng tạo trang 31)
Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân lớp p. Các phân lớp s đều chứa số electron tối đa, còn phân lớp p chỉ chứa một nửa số electron tối đa. Nguyên tử nitrogen có bao nhiêu electron.
Thảo luận (1)Hướng dẫn giảiPhân lớp `p` có tối đa là `6 e=>` Nguyên tử `N` ở phân lớp `p` có `3 e`
`=>` Nguyên tử `N` có `2+2+3=7 e`
(Trả lời bởi 2611)
Câu hỏi 12 (SGK Chân trời sáng tạo trang 31)
Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp.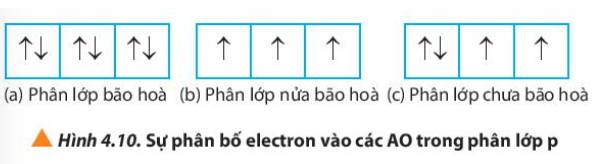
Thảo luận (2)Hướng dẫn giải(a) Phân lớp bão hòa => Không có electron độc thân
(b) Phân lớp nửa bão hòa => Số electron độc thân = số orbital của phân lớp đó
(c) Phân lớp chưa bão hòa => số electron độc thân nhỏ hơn số orbital trong phân lớp đó
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 13 (SGK Chân trời sáng tạo trang 31)
Hãy đề nghị cách phân bố electron vào các orbital để số electron độc thân là tối đa.
Thảo luận (1)Hướng dẫn giảiTrong một orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ 2 được biểu diễn bằng mũi tên quay xuống. Electron được điền vào các orbital theo thứ tự từ trái sang phải.
Cách phân bố electron vào các orbital để số electron độc thân là tối đa:
Biểu diễn các electron bằng mũi tên đi lên vào lần lượt các orbital trước, sau đó mới quay lại biểu diễn các electron bằng mũi tên đi xuống vào các orbital.
(Trả lời bởi Toru)
Luyện tập (SGK Chân trời sáng tạo trang 31)
Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron vào các orbital tuân theo và không tuân theo quy tắc Hund.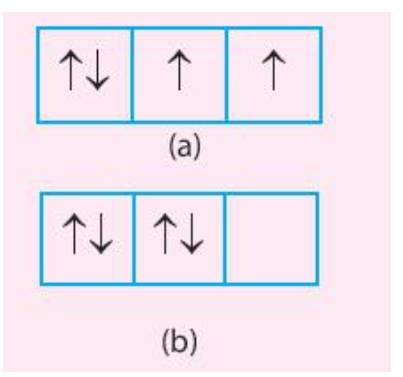
Thảo luận (1)Hướng dẫn giảiCả 2 trường hợp (a) và (b) đều chưa đạt được phân lớp bão hòa
- Trường hợp (a) có 2 electron độc thân => Số electron độc thân đã tối đa
- Trường hợp (b) không có electron độc thân => Số electron độc thân chưa tối đa
=> Trường hợp (a) tuân theo quy tắc Hund, trường hợp (b) không tuân theo quy tắc Hund
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 14 (SGK Chân trời sáng tạo trang 32)
Cấu hình electron của một nguyên tử cho biết những thông tin gì?
Thảo luận (1)Hướng dẫn giảiCấu hình electron cho biết: số electron trên phân lớp, số electron lớp ngoài cùng, số lớp electron của nguyên tử.
(Trả lời bởi Quoc Tran Anh Le)
Luyện tập (SGK Chân trời sáng tạo trang 32)
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Thảo luận (2)Hướng dẫn giải- Nguyên tử có Z = 13 => Có 13 electron
- Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron)
- Điền các electron: 1s22s22p63s23p1
=> Nguyên tử aluminium có 1 electron độc thân
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 15 (SGK Chân trời sáng tạo trang 33)
Quan sát Bảng 4.2, hãy cho biết dựa trên cơ sở nào để dự đoán phosphorus là nguyên tố phi kim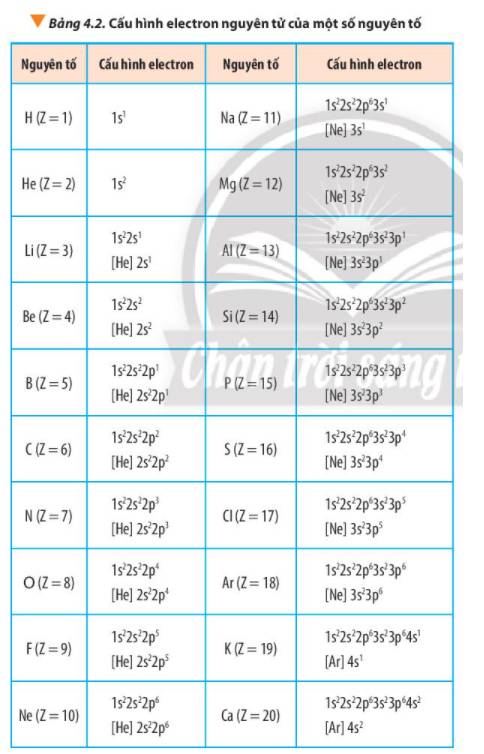
Thảo luận (1)Hướng dẫn giảiDự đoán `P` là nguyên tố phi kim vì `P` có `5 e` lớp ngoài cùng.
(Các nguyên tố mà nguyên tử có `5;6;7 e` lớp ngoài cùng là nguyên tố phi kim)
(Trả lời bởi 2611)