Dự đoán `P` là nguyên tố phi kim vì `P` có `5 e` lớp ngoài cùng.
(Các nguyên tố mà nguyên tử có `5;6;7 e` lớp ngoài cùng là nguyên tố phi kim)
Dự đoán `P` là nguyên tố phi kim vì `P` có `5 e` lớp ngoài cùng.
(Các nguyên tố mà nguyên tử có `5;6;7 e` lớp ngoài cùng là nguyên tố phi kim)
Lithium là một nguyên tố có nhiều công dụng, được sử dụng trong chế tạo máy bay và trong một số loại pin nhất định. Pin Lithium-lon (pin Li-lon) đang ngày càng phổ biến, nó cung cấp năng lượng cho cuộc sống của hàng triệu người mỗi ngày thông qua các thiết bị như máy tính xách tay, điện thoại di động, xe Hybrid, xe điện,… nhờ trọng lượng nhẹ, cung cấp năng lượng cao và khả năng sạc lại. Dựa vào cấu hình electron nguyên tử (Bảng 4.2), hãy dự đoán lithium là kim loại, phi kim hay khí hiếm?
Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.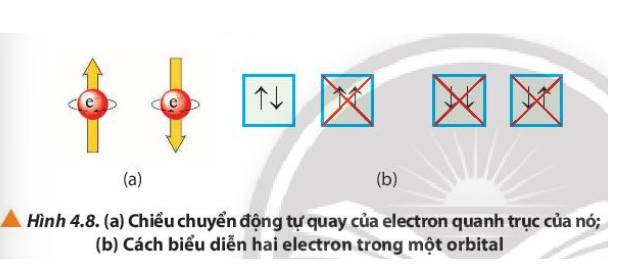
Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử của các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm.
Quan sát Hình 4.1 và 4.2, so sánh điểm giống nhau và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.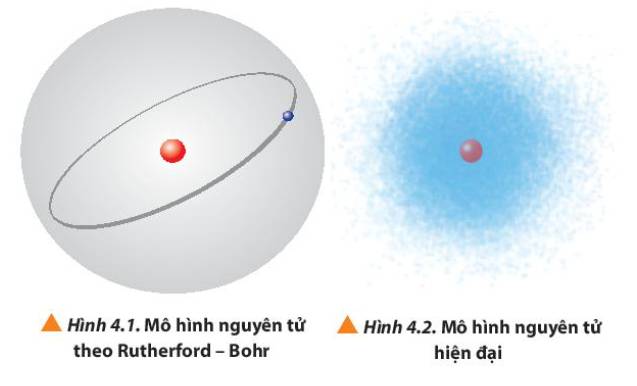
Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp.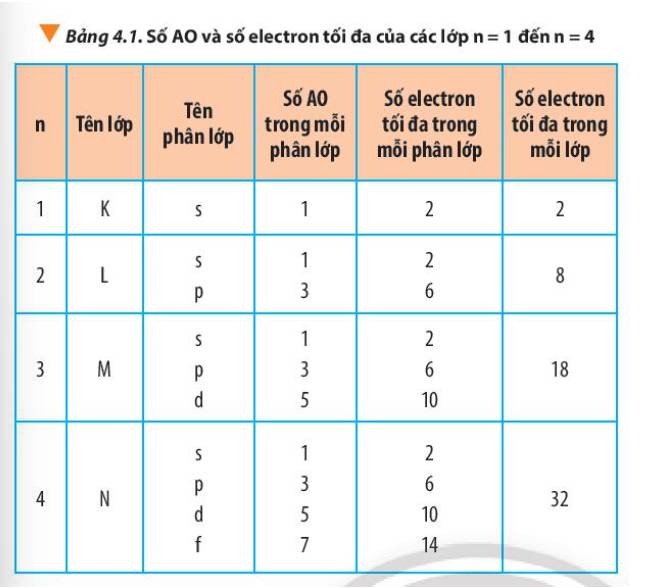
Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của các electron trên các AO ở trạng thái cơ bản (trạng thái có năng lượng thấp nhất).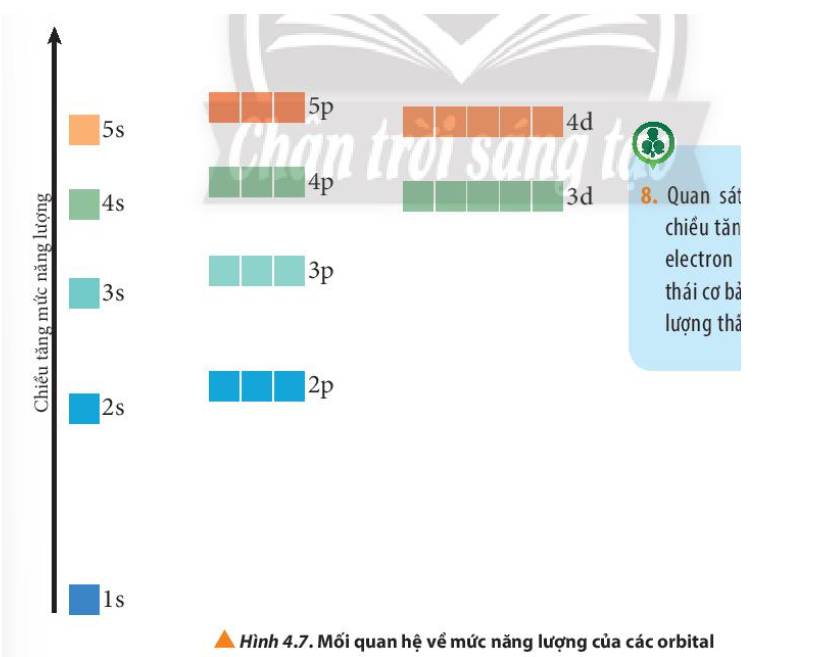
Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)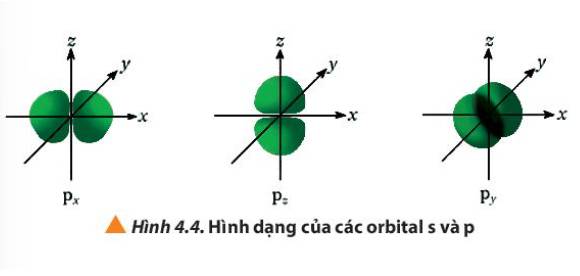
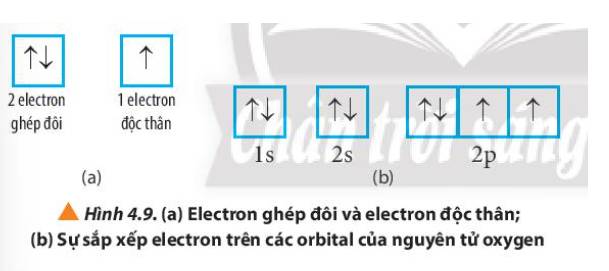
Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi và bao nhiêu electron độc thân.