- Nguyên tử oxygen có:
+ 6 electron ghép đôi nằm ở orbital 1s, 2s và 1 orbital 2p
+ 2 electron độc thân nằm ở 2 orbital 2p
Nguyên tử oxygen có 6 electron ghép đôi và 2 electron độc thân.
- Nguyên tử oxygen có:
+ 6 electron ghép đôi nằm ở orbital 1s, 2s và 1 orbital 2p
+ 2 electron độc thân nằm ở 2 orbital 2p
Nguyên tử oxygen có 6 electron ghép đôi và 2 electron độc thân.
Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử của các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm.
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân lớp p. Các phân lớp s đều chứa số electron tối đa, còn phân lớp p chỉ chứa một nửa số electron tối đa. Nguyên tử nitrogen có bao nhiêu electron.
Cấu hình electron của một nguyên tử cho biết những thông tin gì?
Hãy đề nghị cách phân bố electron vào các orbital để số electron độc thân là tối đa.
Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp.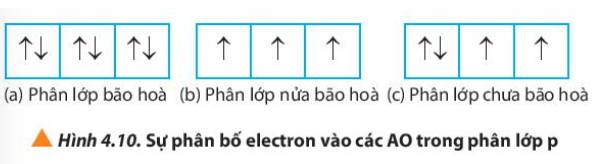
Cho nguyên tố X có 2 lớp electron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X.
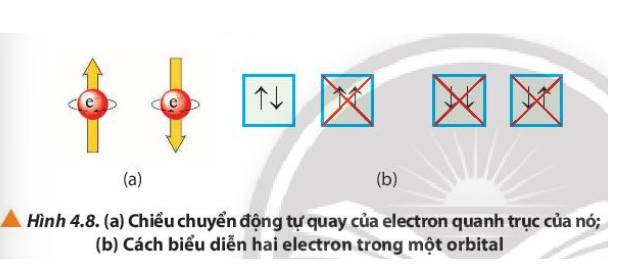
Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.