Trong nguyên tử, các electron chuyển động như thế nào và chiếm những mức năng lượng nào? Trình tự sắp xếp các mức năng lượng này ra sao? Việc phân bố các electron trong nguyên tử tuân theo những nguyên lí và quy tắc nào?
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Mở đầu (SGK Chân trời sáng tạo trang 26)
Thảo luận (2)
Câu hỏi 1 (SGK Chân trời sáng tạo trang 26)
Quan sát Hình 4.1 và 4.2, so sánh điểm giống nhau và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.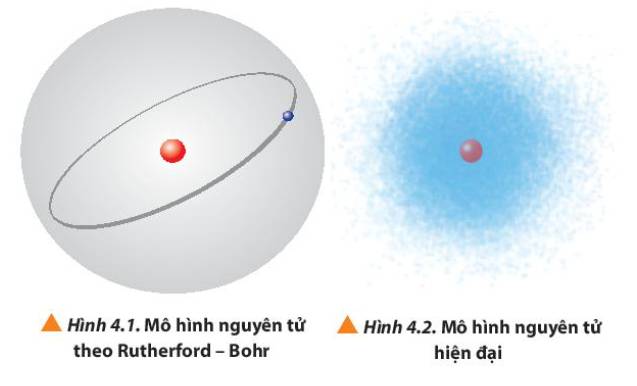
Thảo luận (1)Hướng dẫn giảiGiống nhau: Chuyển động xung quanh hạt nhân
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Khác nhau
Hình 4.1: Quỹ đạo hình tròn hoặc bầu dục xác định xung quanh hạt nhân
Hình 4.2: Chuyển động rất nhanh xung quanh hạt nhân, không theo quỹ đạo xác định
Vận dụng (SGK Chân trời sáng tạo trang 27)
Hệ Mặt Trời gồm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo xác định. Hãy cho biết mô hình nguyên tử của nhà khoa học nào được gọi là mô hình hành tinh nguyên tử, tương tự như hệ Mặt Trời?
Thảo luận (1)Hướng dẫn giải- Các thiên thể quay quanh Mặt Trời theo quỹ đạo xác định.
- Theo Rutherford – Bohr: các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
⇒ Mô hình nguyên tử của Rutherford – Bohr được gọi là mô hình hành tinh nguyên tử, tương tự như hệ Mặt Trời
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Câu hỏi 2 (SGK Chân trời sáng tạo trang 27)
Quan sát Hình 4.3, phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử.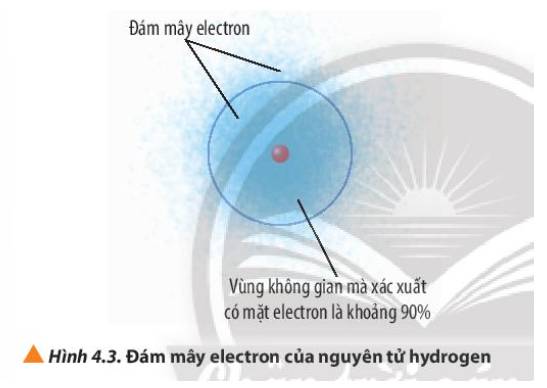
Thảo luận (1)Hướng dẫn giải- Đám mây electron là khu vực có sự có mặt của electron xung quanh hạt nhân
- Orbital nguyên tử là khu vực mà xác suất có mặt electron là 90% xung quanh hạt nhân
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Câu hỏi 3 (SGK Chân trời sáng tạo trang 27)
Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford – Bohr hay mô hình nguyên tử hiện đại.
Thảo luận (1)Hướng dẫn giảiOrbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90%
⇒ Xuất phát từ mô hình nguyên tử hiện đại vì electron chuyển động không theo quỹ đạo, mật độ electron không giống nhau
(Trả lời bởi Phía sau một cô gái)
Câu hỏi 4 (SGK Chân trời sáng tạo trang 27)
Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)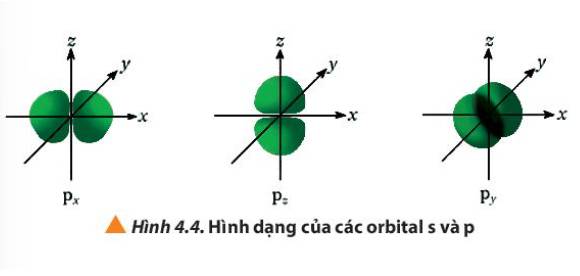
Thảo luận (2)Hướng dẫn giải(Trả lời bởi Mai Trung Hải Phong)
px
py
pz
Giống nhau
Đều có hình dạng là số 8 nổi
Khác nhau
Nằm trên trục Ox
Nằm trên trục Oy
Nằm trên trục Oz
Câu hỏi 5 (SGK Chân trời sáng tạo trang 28)
Quan sát Hình 4.5, nhận xét cách gọi tên các lớp electron bằng các chữ cái tương ứng với các lớp từ 1 đến 7.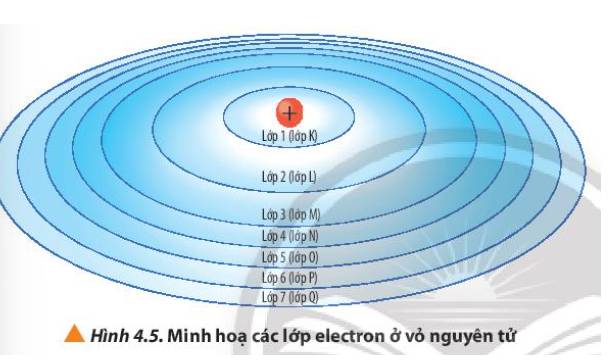
Thảo luận (2)Hướng dẫn giải- Lớp 1 – Lớp K
- Lớp 2 – Lớp L
- Lớp 3 – Lớp M
- Lớp 4 – Lớp N
- Lớp 5 – Lớp O
- Lớp 6 – Lớp P
- Lớp 7 – Lớp Q
=> Cách gọi tên theo bảng chữ cái từ K đến Q lần lượt ứng với các lớp từ 1 đến 7
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 6 (SGK Chân trời sáng tạo trang 28)
Từ Hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp nào là nhỏ nhất.
Thảo luận (2)Hướng dẫn giải- Lớp K gần hạt nhân nhất => Lực hút của hạt nhân với electron ở lớp K là lớn nhất
- Lớp Q nằm xa hạt nhân nhất => Lực hút của hạt nhân với electron ở lớp Q là nhỏ nhất
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 7 (SGK Chân trời sáng tạo trang 28)
Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các các lớp từ 1 đến 4.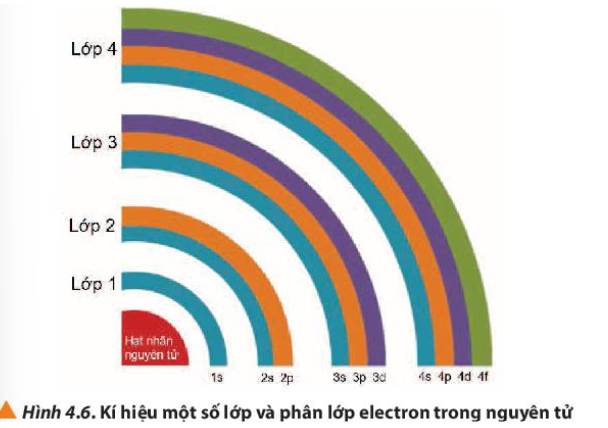
Thảo luận (1)Hướng dẫn giải- Lớp 1 có 1 phân lớp
- Lớp 2 có 2 phân lớp
- Lớp 3 có 3 phân lớp
- Lớp 4 có 4 phân lớp
=> Từ lớp 1 đến lớp 4, số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Câu hỏi 8 (SGK Chân trời sáng tạo trang 29)
Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của các electron trên các AO ở trạng thái cơ bản (trạng thái có năng lượng thấp nhất).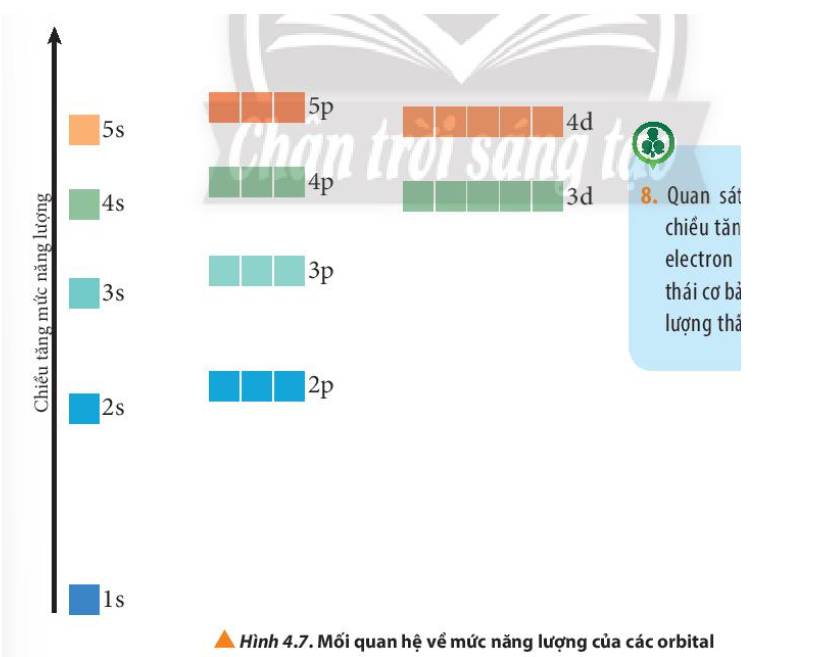
Thảo luận (1)Hướng dẫn giảiỞ trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p…
(Trả lời bởi GV Nguyễn Trần Thành Đạt)