đốt cháy hỗn hợp X gồm 2,4 gam Mg , 4,48 gam Fe bằng V lít hỗn hợp khí Y gồm O2 và Cl2 thu được hỗn hợp rắn Z gồm các muối clorua và oxit( ko còn khí dư). hòa tan Z bằng 160 ml dung dịch HCl 1M vừa đủ được dung dịch T. cho dung dihcj T tác dụng với dd AGNO3 dư thu được 62,785 gam kết tủa. giá trị V là
Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
Coi rằng hh Y gồm O và x mol Cl cho đơn giản.
+) Z + HCl sinh ra muối và H2O, tất cả Oxi đã chui vào nước nên:
\(n_O=n_{H2O}=\frac{1}{2}n_{HCl}=\frac{0,16}{2}=0,08\left(mol\right)\)
+) Xét sự thay đổi số oxi hóa toàn bộ quá trình phản ứng:
\(Mg^0\rightarrow Mg^{2+};Fe^0\rightarrow Fe^{3+}\)
\(O\rightarrow O^{2-};Cl\rightarrow Cl^-;Ag^+\rightarrow Ag\downarrow\)
Bảo toàn e, ta có:
\(2n_{Mg}+3n_{Fe}=2n_O+n_{Cl}+n_{Ag}\)
\(\Rightarrow n_{Ag}=0,1\cdot2+0,08\cdot3-0,08\cdot2-x=0,28-x\left(mol\right)\)
+) Bảo toàn nguyên tố Cl, ta có:
\(n_{AgCl\downarrow}=n_{Cl}+n_{HCl}=x+0,16\left(mol\right)\)
+) 62,785 gam kết tủa gồm Ag và AgCl,
\(62,785=143,5\left(x+0,16\right)+108\left(0,28-x\right)\\ \Rightarrow x=0,27\)
Vậy hh Y chứa 0,08 mol O và 0,27 mol Cl
Hay Y chứa 0,04 mol O2 và 0,135 mol Cl2
V=(0,04+0,135)*22,4=3,92(l)
Đúng 0
Bình luận (1)
cho m gam P2O5 vào 700 ml dung dịch KOH 1M, sau khi kết thúc phản ứng cô cạn dung dịch được 3m+5,4 gam chất răn. giá trị m?
Đúng 0
Bình luận (2)
Dãy điện hóa là gì? Có ý nghĩa như thế nào?
Xem chi tiết
- Dãy điện hóa của KL là dãy gồm các cặp oxh/khử của KL được sắp xếp theo giá trị tăng dần.
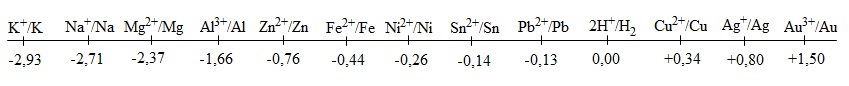 - Ý nghĩa của dãy điện hóa:
- Ý nghĩa của dãy điện hóa:
+ So sánh tính oxi hóa-khử : KL ở đầu dãy (giá trị thế điện cực âm) thì tính khử của KL đó càng mạnh. KL ở cuối dãy (giá trị thế điện cực dương) thì tính khử rất yếu.
+ Xác định chiều của các phản ứng oxi hóa khử : KL đứng trước sẽ phản ứng với muối của KL đứng sau. (quy tắc anpha)
Đúng 0
Bình luận (0)
Dãy điện hóa là một dãy các cặp oxi hóa - khử được xếp theo chiều tính oxi hóa của dạng oxi hóa tăng dần và tính khử của dạng khử giảm dần.

* Ý nghĩa: 4 ý nghĩa
- Từ trái sang phải, độ hoạt động của kim loại giảm dần.
- Những kim loại có độ hoạt động mạnh như K, Na, Ca rất ái lực vs nc để tạo bazo kiềm tương ứng và giải phóng Hidro.
-KL t/d vs đ axit cho ra muối và giải phóng Hidro.Với 2 ĐK:
KL phải đứng trước Hidro trg dãy hoạt động hóa học
dd axit tham gia phải loãng.
- KL t/d vs dd Muối cho ra Muối mới và KL mới. Vs 3 ĐK:
KL của đơn chất phải đứng trước KL của hợp chất Trong dãy hoạt động hóa học
dd muối t/ gia phải tan
KL của đơn chất phải bắt đầu từ Mg trg DHĐHH
Đúng 0
Bình luận (0)
Quy tắc anphal có chiều mũi tên ngược lại không? Vì sao
Quy tắc α (anpha) : Phản ứng oxi hóa khử sẽ xảy ra theo hướng :chất oxi hóa mạnh nhất sẽ oxi hóa chất khử mạnh nhất để sinh ra chất oxi hóa và chất khử yếu hơn.(ko xảy ra theo chiều ngược lại)
Đúng 0
Bình luận (0)
cho 58 g FeCO3 tác dụng với HNO3 vừa đủ thu được hỗn hợp khí gồm CO2 và NO và dung dịch X. cho dung dịch HCl rất dư vào 1/10 dung dịch X thu được dung dịch Y. DUng dịch Y hòa tan tối đa m (g) bột Cu sinh ra khí NO ( sản phẩm khử duy nhát ) . tính m
nFeCO3 = 0,5 mol => nFe(NO3)3 = 0,5.
=> 1/10 dd X có 0,05 mol Fe3+ và 0,15 mol NO3-
=> nCu = (0,05.1 + 0,15.3) : 0,2 = 0,25 => m = 0,25. 64 = 16g
Đúng 0
Bình luận (1)
dung dịch A gồm 0,02 mol Fe(NO3)3 và 0,04 mol HNO3 và 0,36mol HCl . dung dịch A hòa tan tối đa m(g) hỗn hợp B gồm Fe và Cu có tỉ lệ 1:1. Sau phản ứng chỉ thoát ra khí NO ( sản phẩm khử duy nhất ) . tính m
cho 2,88g Mg vào 100ml dung dịch feCl3 khuấy kĩ đến phản ứng hoàn toàn thu được dung dịch X và m(g) chất rắn Y. khối lượng chất tan trong dung dịch X và trong dd FeCl3 ban đầu là 1,76g . tính nồng độ mol chất tan trong dd X và giá trị m
cho hỗn hợp gồm 1,12g Fe và 0,27g Al vào 200ml dd AgNO3 a (M) . sau phản ứng hoàn toàn thu được 2,64g chất rắn . tính a
Số mol Fe = 0,02 mol. Số mol Al = 0,01 mol. Số mol AgNO3 = 0,2a mol.
Ta thấy 2,64: 108 = 0,0244444444444... => Có Fe dư
=> Fe dư = 2,64 - 21,6a => Fe pứ = 21,6a - 1,52
Ta có 2. (21,6a - 1,52)/ 56 + 0,01.3 = 0,2a => a = 0,0425.
Đúng 0
Bình luận (0)
cho 5,6g bột Fe vào 200ml dung dịch AgNo3 a (M) . sau khi phản ứng hoàn toàn thu được dung dịch chứa 7,2g muối fe(no3)2 . tính giá trị a
Số mol fe(no3)2 là 0,04 mol nên số mol agno3 pứ là 0,04 => a = 0,2(lít(
Đúng 0
Bình luận (0)
Ta có nFe = \(\dfrac{5,6}{56}\) = 0,1 ( mol )
nFe(NO3)2 = \(\dfrac{7,2}{180}\) = 0,04 ( mol )
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
0,1 0,04
Lập tỉ số: \(\dfrac{0,1}{1}\):\(\dfrac{0,04}{1}\) = 0,1 > 0,04
=> Sau phản ứng: Fe dư
Fe(NO3)2 hết
=> Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
0,04 \(\leftarrow\) 0,08 \(\leftarrow\) 0,04 → 0,08
=> CM Ag(NO3) = n : V = 0,08 : 0,2 = 0,4 M
Đúng 0
Bình luận (2)
Xem thêm câu trả lời
cho hỗn hợp gồm Fe , Cu , Al vào bình chứa 300ml dd H2So4 0,1M . khuấy kĩ để phản ứng xảy ra hoàn toàn thu được 448ml khí và còn lại 0,32g chất rắn không tan. thêm tiếp vào bình 0,425g NaNO3 thấy thoát ra V(l) khí NO( là sp khử duy nhất) . tính V và khối lượng muối thu được khi cô cạn dd sau phản ứng
- 0,32 chất rắn ko tan là Cu. => nCu = 0,005 mol
- Số mol axit = 0,03. Số mol H2 = 0,02 mol => Axit dư = 0,01 mol.
Số mol NaNO3 = 0,005. => Số mol H+ = 0,02, số mol NO3- = 0,005.
- Gọi số mol Fe là x, Al là y.
Ta có: x + 1,5y = 0,02.
-. 3Cu + 8H+ + 2NO3- ---> 3Cu2+ + 2NO + 4H2O
0,005---0,04/3---0,01/3-----------------0,01/3
=> H+ còn 0,02 - 0,04/3 = 0,02/3 và NO3- còn 0,005 - 0,01/3 = 0,005/3
3Fe2+ + 4H+ + NO3- ----> 3Fe3+ + NO + 2H2O
0,005---0,02/3 ---0,005/3 -----------0,005/3
Vậy dung dịch sau pư chỉ chứa muối sunfat.
ta có nFe = 0,005 => nAl = 0,01.
=> mmuối = mFe + mAl + mCu + mNa + mSO4 = 0,005.56 + 0,01. 27 + 0,32 + 0,005.23 + 0,03.96 = 3,865g.
V = 0,005.22,4 = 0,112 lít.
Đúng 0
Bình luận (0)
hòa tan hết 1 hỗn hợp gồm 16,8g Fes2 và 13,92g Fe3O4 trong 200 dd gồm HNO3 4M và H2SO4 2M. sau khi hòa tan được dung dịch X mà dd X hòa tan tối đa m(g) bột Cu. biết khí NO là sp khử duy nhất . tính m
FeS2 0,14 mol. Fe3O4 = 0,06 mol. HNO3 0,8 mol. H2SO4 0,4 mol
=> Quy đổi: Fe = 0,14 + 0,06.3 = 0,32 mol. S = 0,14.2 = 0,28 mol. O = 0,06.4 = 0,24 mol
- Bảo toàn e: 0,32.3 + 0,28.6 - 0,24.2 = 3nNO
=> nNO = 0,72 mol => Bảo toàn ni tơ: trong dd có NO3- = 0,8 - 0,72 = 0,08 mol.
Mặt khác: Fe3+ = 0,32 mol. SO42- = 0,28 + 0,4 = 0,68 mol. => H+ dư = 0,68.2 + 0,08 - 0,32.3 = 0,48 mol.
=> 3Cu + 8H+ + 2NO3- ----> 3Cu2+ + 2NO + 4H2O
0,12 <----------- 0,08 mol
Cu + 2Fe3+ ---> Cu2+ + 2Fe2+
0,16<---- 0,32 mol
Vậy mCu cần dùng = (0,12 + 0,16).64 = 17,92g
Đúng 0
Bình luận (0)










