Cân bằng hộ mik mấy phương trình này với
FemOn+HNO3->Fe(NO3)3+NO+H2O
Tuyển Cộng tác viên Hoc24 nhiệm kì 28 tại đây: https://forms.gle/GrfwFgzveoKLVv3p6
Cân bằng hộ mik mấy phương trình này với
FemOn+HNO3->Fe(NO3)3+NO+H2O
\(3Fe_mO_n+\left(12m-2n\right)HNO_3\rightarrow3mFe\left(NO_3\right)_3+\left(3m-2n\right)NO+\left(6m-n\right)H_2O\)
So sánh thể tích khí oxi thu được (đktc) khi nhiệt phân hoàn toàn KMnO4,KClO3KMnO4,KClO3 trong các trường hợp sau :
a) Các chất có cùng khối lượng.
b) Các chất có cùng số mol.
PTHH của phản ứng điều chế khí oxi :
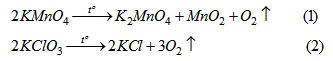
Nếu các chất có cùng khối lượng :
Theo (1) : 316 g KMnO4KMnO4 điều chế được 1 mol O2O2.
Theo (2) : 245 g KClO3KClO3 điểu chế được 3 mol O2O2.
Vậy 316 g KClO3KClO3 điều chế được : 3.316245≈3,87(mol)O23.316245≈3,87(mol)O2.
Kết luận : Nếu dùng cùng một khối lượng thì thể tích khí oxi thu được từ KClO3KClO3 nhiều hơn 3,87 lần so với KMnO4KMnO4.
b) Nếu các chất có cùng số mol :
Theo (1): 2 mol KMnO4KMnO4 điều chế được 1 mol khí O2O2.
Theo (2) : 2 mol KClO3KClO3 điều chế được 3 moi khí O2O2.
Kết luận : Nếu dùng cùng số mol thì thể tích khí oxi thu được từ KClO3KClO3 nhiều hơn 3 lần so với KMnO4KMnO4.
Điền vào bảng sau để so sánh hai thí nghiệm về điện phân các dung dịch :
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương (anot) |
Sản phẩm ở cực âm (catot) |
|
Khí oxi |
|
|
|
|
Khí clo |
|
|
|
Viết các phương trình điện phân.
Ta có bảng sau khi điền
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương |
Sản phẩm ở cực âm |
|
Khí oxi |
H2O pha thêm H2SO4 |
Khí oxi |
Khí hiđro |
|
Khí clo |
NaCl (có màng ngăn) |
Khí clo |
Khí hiđro |
Phương trình điện phân :
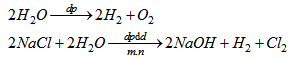
Nếu lấy 3 chất KMnO2 , KClO3, KNO2 , để điều chế oxi thì chất nào sẽ điều chế được oxi nhiều hơn trong 2 trường hợp sau :
a. Khối lượng 3 chất bằng nhau
b. Số mol 3 chất bằng nhau
bạn ghi sai đề à,\(KMnO_4\) và \(KNO_3\)sao lại KMn\(O_2\)và \(KNO_2\):
2\(KMnO_4\)\(\rightarrow\)\(K_2MnO_4\)+\(MnO_2\)+O\(_2\)
\(\rightarrow\)1g \(KMnO_4\) điều chế được \(\dfrac{8}{79}\)\(\simeq\)0,1013g \(O_2\)
\(\Leftrightarrow\)1 mol \(KMnO_4\) điều chế được 16 g \(O_2\)
2KCl\(O_3\)\(\rightarrow\)2KCl+3\(O_2\)
\(\rightarrow\)1g \(KClO_3\) điều chế được \(\dfrac{96}{475}\simeq\)0,102g \(O_2\)
\(\Leftrightarrow\)1 mol KCl\(O_3\) điều chế được 48 g\(O_2\)
2KNO\(_3\)\(\rightarrow\)2KNO\(_2+O_2\)
\(\rightarrow1g\) \(KNO_3\) điều chế được\(\dfrac{16}{101}\)\(\simeq\)0,1584g \(O_2\)
\(\Leftrightarrow\)1 mol \(KNO_3\) điều chế được 16 g O\(_2\)
vậy nếu dùng 3 chất trên để điều chế oxi thì:
+nếu khối lượng 3 chất để điều chế oxi thì dùng KNO\(_3\) sẽ điều chế được nhiều oxi nhất
+nếu số mol 3 chất để điều chế oxi thì dùng KClO\(_3\) sẽ điều chế được nhiều oxi nhất
đốt cháy 11,9 gam hỗn hợp gồm Zn,AL trong khí CL2 dư . sau khi các phản ứng xảy ra hoàn toàn ,thu được 40,3 gam hỗn hợp muối .tính thể tích CL2 (đktc) đã phản ứng là
nCl2 = (40,3-11,9)/71 = 0,4
=> VCl2 = 8,96 lít
oxi hóa hoàn toàn m gam kim loại X cần vừa đủ 0,25m gam khí O2. X là kim loại nào
4M+xO2--->2M2Ox
nO2=7,8125.10^-3.m
-->nM=0,03125m/x
---> M =32x
với x=2 --->M=64(Cu)
cho dung dịch HCL đặc ,dư tác dụng với 6,96 gam MnO2 . lượng khí cho sinh ra oxi hóa hoàn toàn kim loại M , tạo ra 7,6 gam muối . kim loại M là
đốt cháy a gam C trong oxi thu đc 4,4, lít khhis CO2 duy nhất. xác định giá trị của a cần dùng
nCO2 = \(\dfrac{4,4}{22,4}=0,196\left(mol\right)\)
C + O2 --to-> CO2
0,196 <-----0,196
=> mC = 0,196 . 12 = 2,352 (g)
đốt 13g bột kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2g ( giả sử hiệu suất phản ứng là 100%). kim loại đó là gì ???
gọi kim loại đó là A
2A + O2 ==> 2AO
0,2<==0,1
ta có :
mO2= 16,2-13= 3,2 g
=> nO2= 3,2/32= 0,1 mol
MA= 13/0,2=65 g
=> A là kẽm (Zn)
vì sao CuS ko tác dụng được với HCl
đc mak bn
CuS + 2HCl → CuCl2 + H2S
P/s vào từ điển phương trình hóa học mak xem