Quan sát thí nghiệm 1 (Hình 6.11, 6.12) và đánh dấu V để hoàn thành bảng sau:
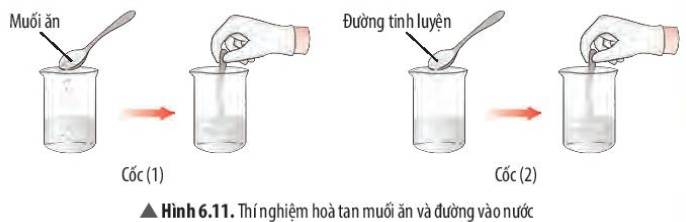
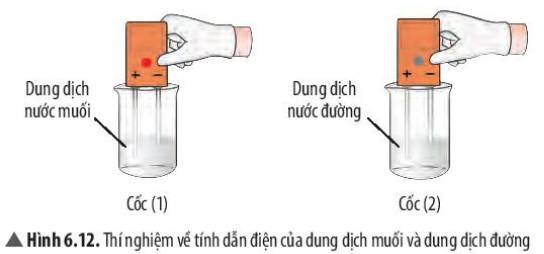
Quan sát thí nghiệm 1 (Hình 6.11, 6.12) và đánh dấu V để hoàn thành bảng sau:



Quan sát thí nghiệm 2 (Hình 6.13), cho biết muối hay đường bền nhiệt hơn. Ở ống nghiệm nào có sự tạo thành chất mới?

Thảo luận (1)Hướng dẫn giải- Muối không có sự thay đổi sau khi đun nóng
- Đường (màu trắng) chuyển thành chất khác có màu đen
⇒ Ống nghiệm 2 (đường) có sự tạo thành chất mới
⇒ Muối bền nhiệt hơn
(Trả lời bởi HT.Phong (9A5))
Kết quả thử nghiệm tính chất của 2 chất A và B được trình bày ở bảng bên. Em hãy cho biết chất nào là chất cộng hóa trị, chất nào là chất ion?
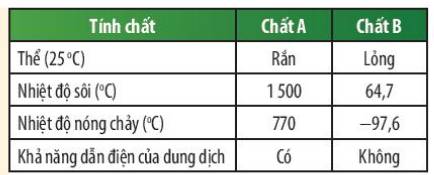
Thảo luận (1)Hướng dẫn giảiDựa vào bảng kết quả thí nghiệm, chất A là chất ion, chất B là chất cộng hóa trị.
(Trả lời bởi Bảo Chu Văn An)
Khi cơ thể bị mất nước do tiêu chảy, nôn mửa,… người ta thường cho bệnh nhân uống dung dịch oresol. Tìm hiểu qua sách báo và internet, hãy cho biết thành phần của oresol có các loại chất nào (chất ion, chất cộng hóa trị)? Trong trường hợp không có oresol thì có thể thay thế bằng cách nào khác không? Giải thích
Thảo luận (1)Hướng dẫn giảiThành phần chính của oresol:
- Sodium chloride (NaCl): Chất ion
- Sodium hydrogen carbonate (NaHCO3): Chất ion
- Potassium chloride (KCl): Chất ion
- Glucose: Chất cộng hóa trị
Oresol được sử dụng bằng cách pha trực tiếp với nước và uống. Công dụng chính là bổ sung nước và các chất điện giải cho cơ thể. Do các chất ion có trong thành phần của oresol khi tan trong các dịch cơ thể tạo ra các ion âm và dương. Các ion này vai trò quan trọng trong quá trình trao đổi chất. Chúng sẽ điều chỉnh và kiểm soát sự cân bằng của dịch cơ thể đồng thời thúc đẩy các quá trình khác trong cơ thể để hoạt động hiệu quả hơn.
Trong trường hợp không có oresol thì có thể thay thế bằng:
- Nước muối đường: Có thành phần tương tự như oresol. Pha theo tỷ lệ 1 thìa cà phê muối, 8 thìa đường và 1 lít nước.
- Nước cháo muối (1,2 lít nước, 1 thìa muối, 1 nắm gạo), đồng thời uống bổ sung nước dừa, nước cam, ăn thêm chuối để bổ sung thêm potassium.
- Nước dừa muối: 1 lít nước dừa, 1 thìa muối.
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết trong phân tử sodium oxide (hình bên)
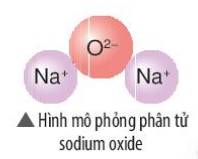
Thảo luận (1)Hướng dẫn giải- Sodium oxide gồm 2 nguyên tố: Na (kim loại) và O (phi kim)
=> Liên kết ion
- Nguyên tử Na (số hiệu nguyên tử = 11) nhường 1 electron => Ion Na+
- Nguyên tử O (số hiệu nguyên tử = 8) nhận 2 electron => Ion O2-
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Cho biết vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O và vẽ sơ đồ hình thành liên kết trong các phân tử ở hình sau:

Thảo luận (1)Hướng dẫn giải- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Potassium chloride là hợp chất có nhiều ứng dụng trong đời sống. Trong nông nghiệp, nó được dùng làm phân bón. Trong công nghiệp, potassium chloride được dùng làm nguyên liệu để sản xuất potassium hydroxide và kim loại potassium. Trong y học, potassium chloride được dùng để bào chế thuốc điều trị bệnh thiếu kali trong máu. Potassium chloride rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hóa, tim, thân, cơ và cả hệ thần kinh
Hợp chất potassium chloride có loại liên kết gì trong phân tử? Vẽ sơ đồ hình thành liên kết có trong phân tử này.

Thảo luận (1)Hướng dẫn giảiHợp chất potassium chloride (KCl) có liên kết ion trong phân tử.
Sự hình thành liên kết trong phân tử potassium chloride
+ Nguyên tử K cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là K+.
+ Nguyên tử Cl nhận 1 electron từ nguyên tử K trở thành ion mang một điện tích âm, kí hiệu là Cl-.
Các ion K+ và Cl- hút nhau tạo thành liên kết trong phân tử potassium chloride.
(Trả lời bởi GV Nguyễn Trần Thành Đạt)