Ở điều kiện thường, các nguyên tử khí hiếm thường trơ, bền và chỉ tồn tại độc lập, trong khi các nguyên tử của nguyên tố khác lại có xu hướng kết hợp với nhau.
Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nào?
Ở điều kiện thường, các nguyên tử khí hiếm thường trơ, bền và chỉ tồn tại độc lập, trong khi các nguyên tử của nguyên tố khác lại có xu hướng kết hợp với nhau.
Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nào?

Trừ helium, vỏ nguyên tử của các nguyên tố còn lại ở Hình 6.1 có những điểm giống và khác nhau gì?
Thảo luận (1)Hướng dẫn giải
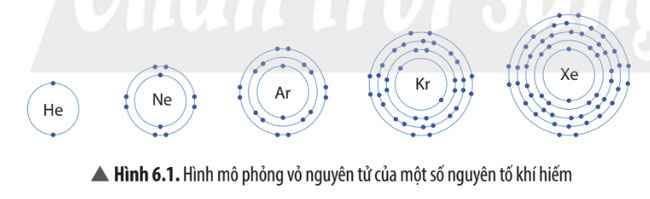
Điểm giống nhau: Ne, Ar, Kr, Xe đều có 8 electron ở ngoài cùng.
(Trả lời bởi Bảo Chu Văn An)
Điểm khác nhau: Số lớp electron và số electron trong mỗi lớp:
- Ne: 2 lớp electron
- Ar: 3 lớp electron
- Kr: 4 lớp electron
- Xe: 5 lớp electron
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
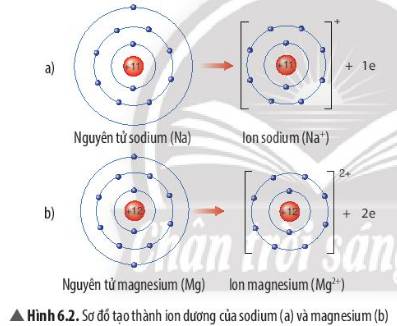
Thảo luận (1)Hướng dẫn giải- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium
Thảo luận (1)Hướng dẫn giảiAluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+
Sơ đồ tạo thành ion aluminium:
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
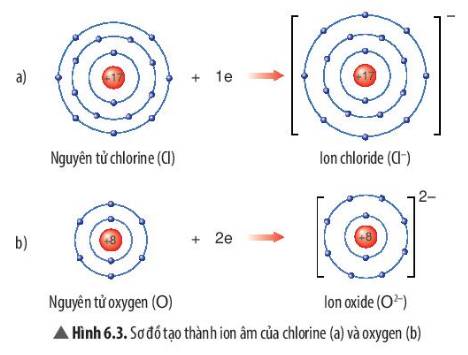
Thảo luận (1)Hướng dẫn giải- Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl-
- Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
- Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
- Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Xác định vị trí của sulfur trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion sulfide (S2-) từ nguyên tử sulfur
Thảo luận (1)Hướng dẫn giảiNguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Quan sát Hình 6.4a, em hãy mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride. Nêu một số ứng dụng của sodium chloride trong đời sống
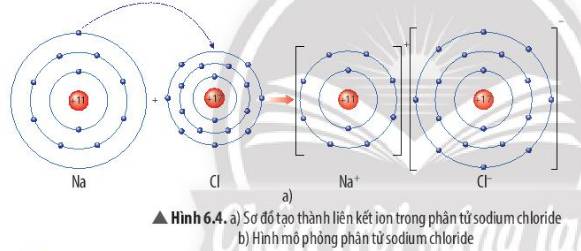
Thảo luận (1)Hướng dẫn giảiMô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride:
Khi nguyên tử sodium (Na) kết hợp với nguyên tử chlorine (Cl), nguyên tử Na nhường 1 electron tạo thành ion dương, kí hiệu là Na+, đồng thời nguyên tử Cl nhận 1 electron từ nguyên tử Na tạo thành ion âm, kí hiệu Cl-. Ion Na+ và Cl- hút nhau tạo phân tử sodium chloride (NaCl).
Một số ứng dụng của sodium chloride trong đời sống:
- Trong công nghiệp
+ Trong công nghiệp sản xuất giày da, người ta sử dụng muối để bảo vệ da.
+ Trong sản xuất cao su, muối dùng để làm trắng các loại cao su.
+ Trong dầu khí, muối là thành phần quan trọng trong dung dịch khoan giếng khoan.
+ Từ muối có thể chế ra các loại hóa chất dùng cho các ngành khác như sản xuất nhôm, đồng, thép, điều chế nước Javel,… bằng cách điện phân nóng chảy hoặc điện phân dung dịch NaCl có màng ngăn.
- Trong nông nghiệp, chăn nuôi
+ Muối giúp cân bằng sinh lý trong cơ thể giúp gia súc, gia cầm phát triển khỏe mạnh, giảm bệnh tật.
+ Giúp phân loại hạt giống theo trọng lượng
+ Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón.
- Trong thực phẩm
+ NaCl dùng trong công nghiệp chế biến thực phẩm. Là thành phẩn chính trong muối ăn và được sử dụng phổ biến.
+ NaCl có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu dẫn đến làm cho vi khuẩn bị mất nước và chết.
+ Dùng muối để ướp thực phẩm sống như tôm, cá,… để không bị ươn, ôi trước khi thực phẩm được nấu.
+ Khử mùi thực phẩm, giữ cho trái cây không bị thâm.
+ Tăng hương vị, kiểm soát quá trình lên men của thực phẩm.
- Trong y tế
+ Muối sodium chloride dùng để sát trùng vết thương rất tốt.
+ Dùng để trị cảm lạnh, pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh cho con người.
+ Cung cấp muối khoáng cho cơ thể thiếu nước.
+ Muối có tác dụng khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, làm trắng răng, chữa hôi miệng,…
- Trong đời sống gia đình
+ Giúp rửa sạch ống thoát bồn rửa chén bát
+ Hỗ trợ tẩy vết trắng trên bàn gỗ để lại bởi ly nước và đĩa nóng, lau chùi chảo gang dính mỡ dễ dàng.
+ Gột rửa hết các vết dơ của mồ hôi, vết máu trên quần áo
+ Trị viêm họng
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide
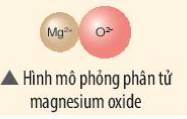
Thảo luận (2)Hướng dẫn giảitham khảo
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:
(Trả lời bởi Mai Trung Hải Phong)
Calcium chloride có nhiều ứng dụng trong đời sống. Tìm hiểu qua sách báo và internet, em hãy cho biết một số ứng dụng của chất này. Vẽ sơ đồ tạo thành liên kết trong phân tử calcium chloride
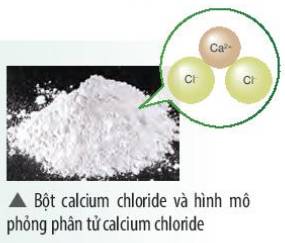
Thảo luận (1)Hướng dẫn giải- Calcium chloride (CaCl2) có một số ứng dụng như: Làm hợp chất làm tan băng, làm chất điện giải hoặc sản xuất các loại đồ uống, có thể ứng dụng trong hệ thống tiêu nước và xử lí nước thải do công nghiệp thải ra.....
(Trả lời bởi Bảo Chu Văn An)
- Sơ đồ tạo thành liên kết trong Calcium chloride:
Dựa vào bảng tuần hoàn, hãy chỉ ra nguyên tố khí hiếm gần nhất của hydrogen và oxygen. Để có lớp electron ngoài cùng giống nguyên tố khí hiếm gần nhất, nguyên tử hydrogen và oxygen có xu hướng gì?
Thảo luận (1)Hướng dẫn giải- Hydrogen gần với nguyên tố khí hiếm Helium
- H có 1 electron lớp ngoài cùng, He có 2 electron lớp ngoài cùng
=> Nguyên tử hydrogen có xu hướng nhận thêm 1 electron để đạt cấu hình của Helium
- Oxygen gần với nguyên tố khí hiếm Neon
- H có 6 electron lớp ngoài cùng, Ne có 8 electron lớp ngoài cùng
=> Nguyên tử Oxygen có xu hướng nhận thêm 2 electron để đạt cấu hình của Neon
(Trả lời bởi GV Nguyễn Trần Thành Đạt)