NaOH + HCl → NaCl + H2O
Bài 2. Cân bằng trong dung dịch nước
Đúng 0
Bình luận (0)
Các câu hỏi tương tự
Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH đã sử dụng là 12,5 mL. Tính nồng độ dung dịch NaOH ban đầu.
Tính pH của dung dịch thu được sau khi trộn 40 mL dung dịch HCl 0,5 M với 60 mL dung dịch NaOH 0,5 M.
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100 mL dung dịch NaOH có pH = 12.
Nếu nhỏ thêm vài giọt dung dịch NaOH hoặc CH3COONa vào dung dịch CH3COOH thì cân bằng (2) chuyển dịch theo chiều nào?
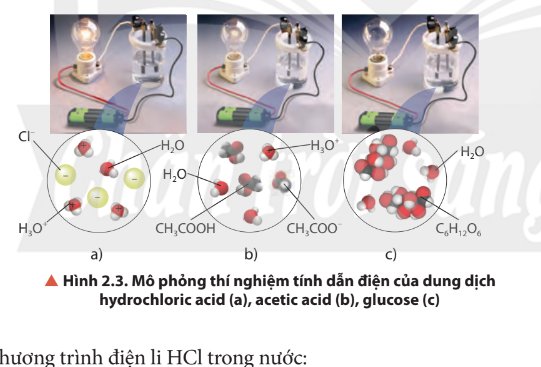
Quan sát Hình 2.3, nhận xét về độ sáng của bóng đèn ở các thí nghiệm. Biết rằng nồng độ mol của các dung dịch là bằng nhau, cho biết dung dịch nào dẫn điện mạnh, dẫn điện yếu và không dẫn điện.
Tại sao khi bảo quản dung dịch muối M3+ trong phòng thí nghiệm người ta thường nhỏ vài giọt dung địch acid vào trong lọ đựng dung dịch muối?
Quan sát Hình 2.9, giải thích vì sao cần lắc nhẹ dung dịch trong bình tam giác trong khi thực hiện thao tác chuẩn độ.

Tính pH của dung dịch có nồng độ H+ là 10-2 M.
Tính pH của dung dịch có nồng độ OH- là 10-4 M.




