Các hợp chất acid và base có vai trò rất quan trọng trong đời sống của con người. Acid, base là gì? Làm cách nào có thể xác định nồng độ của dung dịch acid, base?
Bài 2. Cân bằng trong dung dịch nước
Mở đầu (SGK Chân trời sáng tạo trang 12)
Thảo luận (1)
Câu hỏi 1 (SGK Chân trời sáng tạo trang 12)
Quan sát Hình 2.1, nhận xét hiện tượng xảy ra khi thực hiện thí nghiệm. So sánh tính dẫn điện của nước cất và các dung dich.
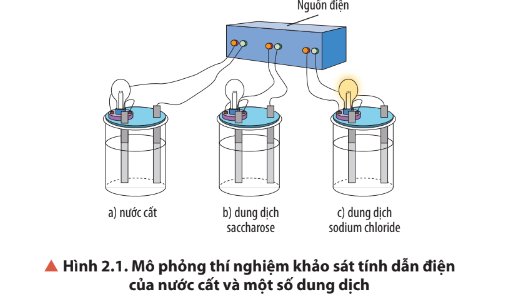
Thảo luận (1)Hướng dẫn giảiHiện tượng: bóng đèn ở cốc đựng dung dịch sodium chloride sáng, bóng đèn ở cốc đựng dung dịch nước cất và saccharose không sáng.
→ Dung dịch sodium chloride dẫn điện, dung dịch nước cất và saccharose không dẫn điện.
(Trả lời bởi Hà Quang Minh)
Câu hỏi 2 (SGK Chân trời sáng tạo trang 13)
Hãy cho biết nguyên nhân vì sao NaCl có tính dẫn điện.
Thảo luận (1)Hướng dẫn giảiH2O là phân tử có cực. Khi cho NaCl tinh thể vào nước, xảy ra quá trình tương tác giữa các phân tử nước có cực và các ion của muối, kết hợp với sự chuyển động hỗn loạn không ngừng của các phân tử nước làm cho các ion Na+ và Cl- của muối tách dần khỏi tinh thể và hoà tan vào nước tạo thành dung dịch dẫn điện.
(Trả lời bởi Hà Quang Minh)
Câu hỏi 3 (SGK Chân trời sáng tạo trang 13)
Quan sát Hình 2.3, nhận xét về độ sáng của bóng đèn ở các thí nghiệm. Biết rằng nồng độ mol của các dung dịch là bằng nhau, cho biết dung dịch nào dẫn điện mạnh, dẫn điện yếu và không dẫn điện.
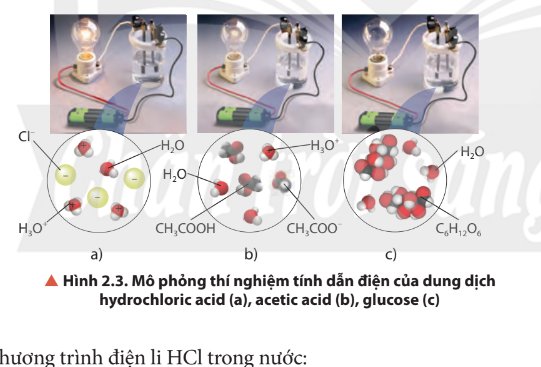
Thảo luận (2)Hướng dẫn giảiĐộ dẫn điện: HCl > acetic acid > glucose.
Trong đó glucose không dẫn điện.
(Trả lời bởi Khai Hoan Nguyen)
Câu hỏi 4 (SGK Chân trời sáng tạo trang 13)
Từ phương trình (1) và (2), nhận xét về mức độ phân li của HCl và CH3COOH trong nước.
Thảo luận (1)Hướng dẫn giải
Câu hỏi 5 (SGK Chân trời sáng tạo trang 14)
Nếu nhỏ thêm vài giọt dung dịch NaOH hoặc CH3COONa vào dung dịch CH3COOH thì cân bằng (2) chuyển dịch theo chiều nào?
Thảo luận (1)Hướng dẫn giảiCH3COOH ⇌ CH3COO- + H+
- Khi nhỏ thêm vài giọt NaOH vào dung dịch CH3COOH, NaOH phân li theo phương trình sau:
\({\rm{NaOH}} \to {\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\)
OH- kết hợp với H+ có trong cân bằng (2): \({{\rm{H}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Vậy khi nhỏ NaOH, lượng H+ trong cân bằng (2) giảm, cân bằng (2) dịch chuyển theo tăng nồng độ H+ (chiều thuận).
- Khi nhỏ thêm vài giọt CH3COONa vào dung dịch CH3COOH, CH3COONa phân li theo phương trình sau:
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COONa}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CO}}{{\rm{O}}^{\rm{ - }}}{\rm{ + N}}{{\rm{a}}^{\rm{ + }}}\)
Vậy khi nhỏ thêm vài giọt CH3COONa, lượng CH3COO- trong cân bằng (2) tăng, cân bằng chuyển dịch theo chiều làm giảm lượng CH3COO- (chiều nghịch).
(Trả lời bởi Quoc Tran Anh Le)
Luyện tập (SGK Chân trời sáng tạo trang 14)
Viết phương trình điện li (nếu có) của các chất sau khi hoà tan vào nước: HNO3, Ca(OH)2 và BaCl2.
Thảo luận (2)Hướng dẫn giải\(HNO_3\rightarrow H^++NO^-_3\\ Ca\left(OH\right)_2\rightarrow Ca^{2+}+2OH^-\\ BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Câu hỏi 6 (SGK Chân trời sáng tạo trang 14)
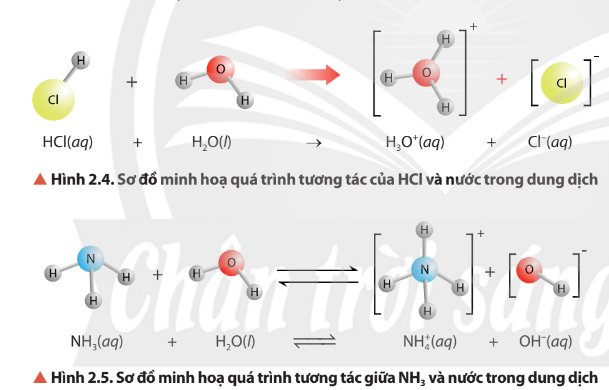
Quan sát Hình 2.4 và Hình 2.5, cho biết chất nào nhận H+, chất nào cho H+
Thảo luận (2)Hướng dẫn giải
Câu hỏi 7 (SGK Chân trời sáng tạo trang 14)
Nhận xét về vai trò acid - base của phân tử H2O trong các cân bằng ở Hình 2.4, Hình 2.5 và cân bằng của ion HCO3-, trong nước.

Thảo luận (1)Hướng dẫn giải- Trong hình 2.4, H2O nhận H+ nên H2O là base.
- Trong hình 2.5, H2O nhường H+ nên H2O là acid.
- Trong cân bằng ion \(HCO_3^-\)
+ H2O nhận H+ nên H2O là base.
+ H2O nhường H+ nên H2O là acid.
(Trả lời bởi Hà Quang Minh)
Luyện tập (SGK Chân trời sáng tạo trang 14)
Cho phương trình:
(1) CH3COOH + H2O ⇌ CH3COO- + H3O+
(2)CO32- + H2O ⇌ HCO3- + OH-
Cho biết chất nào là acid, chất nào base theo thuyết Bronsted – Lowry.
Thảo luận (1)Hướng dẫn giảiTheo thuyết Bronsted - Lowry:
(1) Acetic acid là acid, nước là base
(2) \(CO_3^{^{ }2-}\) là base, nước là acid.
(Trả lời bởi Khai Hoan Nguyen)