Bài 2. Cân bằng trong dung dịch nước
Các câu hỏi tương tự
Tính pH của dung dịch có nồng độ H+ là 10-2 M.
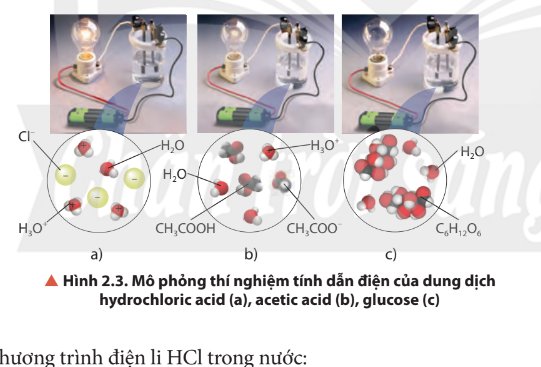
Quan sát Hình 2.3, nhận xét về độ sáng của bóng đèn ở các thí nghiệm. Biết rằng nồng độ mol của các dung dịch là bằng nhau, cho biết dung dịch nào dẫn điện mạnh, dẫn điện yếu và không dẫn điện.
Tính pH của dung dịch có nồng độ OH- là 10-4 M.
Một dung dịch có\({\rm{(O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = 2}}{\rm{,5 x 1}}{{\rm{0}}^{{\rm{ - 10}}}}{\rm{ M}}\). Tính pH và xác định môi trường của dung dịch này.
Các hợp chất acid và base có vai trò rất quan trọng trong đời sống của con người. Acid, base là gì? Làm cách nào có thể xác định nồng độ của dung dịch acid, base?
Viết phương trình hóa học của phản ứng xảy ra trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl.
Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH đã sử dụng là 12,5 mL. Tính nồng độ dung dịch NaOH ban đầu.
Quan sát Hình 2.8, trình bày sự chuyển đổi màu sắc của các chất chỉ thị acid – base trong các dung dịch có độ pH khác nhau.

Nhận xét về vai trò acid - base của phân tử H2O trong các cân bằng ở Hình 2.4, Hình 2.5 và cân bằng của ion HCO3-, trong nước.





