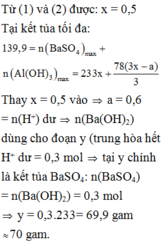cho 200ml dung dịch Na(OH) 1M tác dụng với 294g H2SO4 5%, D=1,5 g/m. Xác định Cm

Những câu hỏi liên quan
cho 200ml dung dịch NaoH 0,05 (M) , tác dụng với 100ml H2SO4 0,005 M Xác định môi trường của dung dịch
2)Cho 6,4 g Fe2O3 td với 500ml dung dich H2SO4 1M
a. Fe2O3 có tan hết không ?
b. Tính CM dung dịch sau pứ
3) Cho 200ml Ba(OH)2 1M vào 300ml dung dịch H2SO4 0,72M
a.Tính kim loại kết tủa thu được
b. Tính Cm dung dịch sau pứ
c. Nhúng quỳ tím vào dung dịch sau pứ nêu hiện tượng gì sảy ra
giúp mình với ạ mình đang gấp
Câu 2:
a, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
\(n_{H_2SO_4}=0,5.1=0,5\left(mol\right)\)
PT: \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,5}{3}\), ta được H2SO4 dư.
Vậy: Fe2O3 tan hết.
b, Theo PT: \(\left\{{}\begin{matrix}n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,04\left(mol\right)\\n_{H_2SO_4\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,5-0,12=0,38\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe_2\left(SO_4\right)_3}}=\dfrac{0,04}{0,5}=0,08\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,38}{0,5}=0,76\left(M\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Câu 3:
a, \(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
\(n_{H_2SO_4}=0,3.0,72=0,216\left(mol\right)\)
PT: \(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_{4\downarrow}+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,216}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow m_{BaSO_4}=0,2.233=46,6\left(g\right)\)
b, Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,216-0,2=0,016\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,016}{0,2+0,3}=0,032\left(M\right)\)
c, - Nhúng quỳ tím vào dd thấy quỳ hóa đỏ do H2SO4 dư.
Đúng 2
Bình luận (0)
Cho 200ml dung dịch H2SO4 1M tác dụng vừa đủ với dung dịch Ba(NO3)2 20%
a) viết phương trình
b) tính thể tích dung dịch Ba(NO3)2 biết (D =1,22g/ml)
c) tính CM của dung dịch thu được sau phản ứng.
Giúp em với ạ !!!!
\(a)H_2SO_4+Ba\left(NO_3\right)_2\rightarrow BaSO_4+2HNO_3\\ n_{H_2SO_4}=0,2.1=0,2l\\ n_{Ba\left(NO_3\right)_2}=n_{H_2SO_4}=0,2mol\\ m_{ddBa\left(NO_3\right)_2}=\dfrac{0,2.261}{20}\cdot100=261g\\ V_{ddBa\left(NO_3\right)_2}=\dfrac{261}{1,22}\approx213,9ml\\ c)n_{HNO_3}=0,2.4=0,4mol\\ C_{M_{HNO_3}}=\dfrac{0,4}{0,2+0,2139}\approx0,97M\)
Đúng 2
Bình luận (0)
Cho 7,8g kim loại A (hóa trị I) tác dụng hết với 200ml H2O thu được baozo và 2,24 lit H2 thoát ra ở đktc . a. Xác định tên kim loại A ? b. Tíh khối lượng m (g) muối thu được c. Tính nồng độ mol (CM) của dung dịch H2SO4 đã dùng ?
cho m(g) kim loại R ( hóa trị 1 ) tác dụng với clo dư , sau phản ứng thu được 13,6g muối . mặt khác để hòa tan m (g) kim loại R cần vừa đủ 200ml dung dịch HCl 1M a, viết PTHH b, xá...
Đọc tiếp
cho m(g) kim loại R ( hóa trị 1 ) tác dụng với clo dư , sau phản ứng thu được 13,6g muối . mặt khác để hòa tan m (g) kim loại R cần vừa đủ 200ml dung dịch HCl 1M a, viết PTHH b, xác định kim loại R
Cho 0,8 g CuO tác dụng với 30 ml dung dịch H 2 S O 4 1M.
Xác định các chất có mặt trong dung dịch thu được sau phản ứng, kèm theo số mol của chúng (Cu=64, O=16).
1.Bằng phương pháp hóa học hãy nhận biết các dung dịch Ba(OH)2,NaCl,Na2SO4,NaOH
2.Hoàn thành dãy chuyển đổi sau:
FeS2-->SO2-->SO3-->H2SO4-->SO2-->Na2SO3
S-->SO2
3.Cho 8(g) CuO tác dụng với 1 lượng dung dịch H2SO4 10%
a)Xác định khối lượng dung dịch H2SO4 đã dùng
b)Xác định nồng độ % của dung dịch thu được sau phản ứng
1. - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa xanh: Ba(OH)2, NaOH (1)
+ Quỳ không đổi màu: NaCl, Na2SO4 (2)
- Cho mẫu thử nhóm (1) pư với dd Na2SO4
+ Có tủa trắng: Ba(OH)2
PT: \(Ba\left(OH\right)_2+Na_2SO_4\rightarrow2NaOH+BaSO_4\)
+ Không hiện tượng: NaOH
- Cho mẫu thử nhóm (2) pư với dd BaCl2
+ Có tủa trắng: Na2SO4
PT: \(Na_2SO_4+BaCl_2\rightarrow2NaCl+BaSO_4\)
+ Không hiện tượng: NaCl.
- Dán nhãn.
Đúng 2
Bình luận (0)
3. \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
a, \(n_{H_2SO_4}=n_{CuO}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{9,8}{10\%}=98\left(g\right)\)
b, \(n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 8 + 98 = 106 (g)
\(\Rightarrow C\%_{CuSO_4}=\dfrac{0,1.160}{106}.100\%\approx15,09\%\)
Đúng 2
Bình luận (0)
2. \(4FeS_2+11O_2\underrightarrow{t^o}8SO_2+2Fe_2O_3\)
\(2SO_2+O_2\xrightarrow[_{V_2O_5}]{^{t^o}}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(H_2SO_4+Na_2SO_3\rightarrow Na_2SO_4+SO_2+H_2O\)
\(SO_2+Na_2O\rightarrow Na_2SO_3\)
\(S+O_2\underrightarrow{t^o}SO_2\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Cho m gam Al tác dụng với V ml dung dịch H2SO4 1M và HCl 1M thu được dung dịch Y. Cho dung dịch Y tác dụng với Ba(OH)2 thì đồ thị biểu diễn sự phụ thuộc của kết tủa vào số mol Ba(OH)2 như sau: Giá trị của y gần nhất với: A. 93 B. 70 C. 58 D. 46,5.
Đọc tiếp
Cho m gam Al tác dụng với V ml dung dịch H2SO4 1M và HCl 1M thu được dung dịch Y. Cho dung dịch Y tác dụng với Ba(OH)2 thì đồ thị biểu diễn sự phụ thuộc của kết tủa vào số mol Ba(OH)2 như sau:
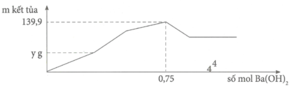
Giá trị của y gần nhất với:
A. 93
B. 70
C. 58
D. 46,5.
Chọn B.
Dung dịch Y có n A l 2 ( S O 4 ) 3 = V/3 = x m o l và n A l C l 3 = V 3 = x m o l .
⇒ n A l 3 + = 3 x m o l = n S O 4 2 -
Tại n B a ( O H ) 2 = 0,75 mol => n O H - = 1,5 mol: lúc này cả 2 kết tủa tối đa với
n A l ( O H ) 3 = 1 / 3 n O H - = 0 , 5 m o l ⇒ n B a S O 4 m a x . 233 + 0 , 5 . 78 = 139 , 9 ⇒ n B a S O 4 m a x = 0 , 433 < 0 , 5 ⇒ v ô l ý
Chứng tỏ trong dung dịch Y còn H+ dư đoạn đồ thị đi lên đầu tiên đến y chỉ có 2 phản ứng là: H + + O H - → H 2 O ⇒ n O H - kết tủa hết Al3+ = 1,5 - a
⇒ n A l ( O H ) 3 m a x = 1 , 5 - a 3 ( 1 ) S O 4 2 - + B a 2 + → B a S O 4 (1)
Dung dịch Y ( : x mol, Cl-: x mol, H+: a mol)
Bảo toàn điện tích: n A l 3 + = 3 x - a 3 ⇒ n A l ( O H ) 3 m a x = 3 x - a 3 (2)
Từ (1) và (2), ta được: x = 0,5 mol
Tại kết tủa tối đa: 139 , 9 = n B a S O 4 m a x + n A l ( O H ) 3 m a x = 233 x + 78 ( 3 x - a ) 3
Thay x = 0,5 vào a = 0,6 mol = n(H+) dư n(Ba(OH)2) dùng cho đoạn y (trung hòa hết H+ dư = 0,3 mol tại y chính là kết tủa
BaSO4: n(BaSO4) = n(Ba(OH)2) = 0,3 mol
=>y = 0,3.233= 69,9 gam ≈ 70 gam.
Đúng 0
Bình luận (0)
Cho m gam Al tác dụng với V ml dung dịch H2SO4 1M và HCl 1M thu được dung dịch Y. Cho dung dịch Y tác dụng với Ba(OH)2 thì đồ thị biểu diễn sự phụ thuộc của kết tủa vào số mol Ba(OH)2 như sau: Giá trị của y gần nhất với: A. 93. B. 70. C. 58. D. 46,5.
Đọc tiếp
Cho m gam Al tác dụng với V ml dung dịch H2SO4 1M và HCl 1M thu được dung dịch Y. Cho dung dịch Y tác dụng với Ba(OH)2 thì đồ thị biểu diễn sự phụ thuộc của kết tủa vào số mol Ba(OH)2 như sau:
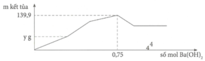
Giá trị của y gần nhất với:
A. 93.
B. 70.
C. 58.
D. 46,5.